آزمون واکنشهای گرماگیر و گرماده
نتایج
تو مسیر درستی قرار داری
میدونی که میتونی بهتر باشی
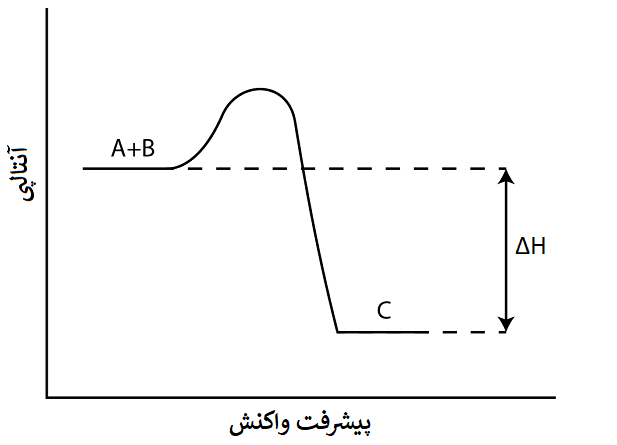
#1. طبق نمودار بالا، واکنش ….
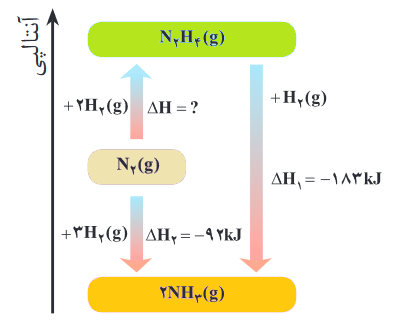
#2. واکنش زیر را در نظر بگیرید: N₂(g) + 3H₂(g) → 2NH₃(g) ; ΔH = ?
دادههای آنتالپی پیوندها:
• آنتالپی پیوند (N≡N) : +941 kJ/mol
• آنتالپی پیوند (H-H) : +436 kJ/mol
• آنتالپی پیوند (N-H) : +391 kJ/mol محاسبه کنید: ΔH واکنش چند kJ است؟
• آنتالپی پیوند (H-H) : +436 kJ/mol
• آنتالپی پیوند (N-H) : +391 kJ/mol
#3. واکنش زیر را در نظر بگیرید: CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
دادههای آنتالپی پیوندها:
• آنتالپی پیوند (C-H) : +415 kJ/mol
• آنتالپی پیوند (O=O) : +495 kJ/mol
• آنتالپی پیوند (C=O) : +799 kJ/mol
• آنتالپی پیوند (O-H) : +463 kJ/mol محاسبه کنید ارزش سوختی متان چقدر است؟ (جرم مولی متان: 16g/mol)
• آنتالپی پیوند (O=O) : +495 kJ/mol
• آنتالپی پیوند (C=O) : +799 kJ/mol
• آنتالپی پیوند (O-H) : +463 kJ/mol
#4. سطح انرژی واکنشدهندهها، کمتر از فراوردههاست؛ نوع واکنش کدام است و چه ویژگیای دارد؟