منظور از آنتالپی همان گرمای واکنش در فشار ثابت است.
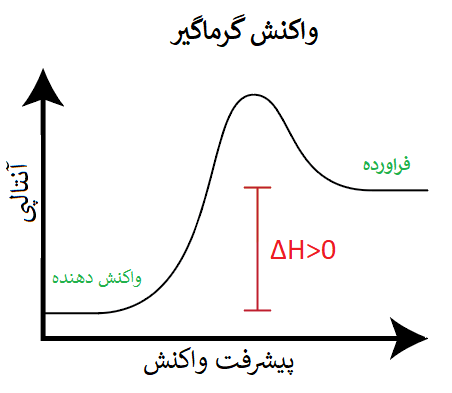
در واکنشهای گرماگیر به این دلیل که واکنش، گرما گرفته است؛ سطح انرژی فرآوردهها از سطح انرژی واکنش دهندهها بیشتر (بالاتر) است:
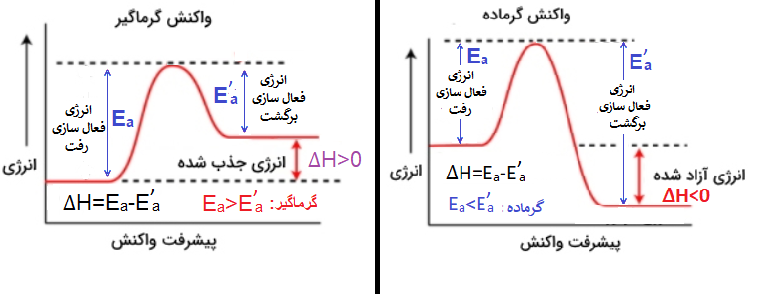
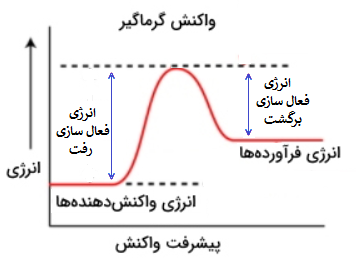
از طرفی هرچه سطح انرژی کمتر باشد، مواد پایدارتر هستند و تمایل آنها برای تغییرات کمتر است، در نتیجه جدا کردنشان از همدیگر سختتر است؛ به همین دلیل در یک واکنش گرماگیر (که سطح انرژی واکنش دهندهها پایینتر از سطح انرژی فرآوردههاست) انرژی فعال سازی تبدیل واکنش دهندهها به فرآوردهها از انرژی فعال سازی تبدیل فرآوردهها به واکنش دهندهها بیشتر است، اصطلاحا به انرژی فعالسازی تبدیل واکنش دهندهها به فرآوردهها، انرژی فعالسازی رفت یا Ea و به انرژی تبدیل فرآوردهها به واکنش دهندههای خود، انرژی فعالسازی برگشت یا E’a گوییم؛ که با توجه به توضیحات داده شده:
در یک واکنش گرماگیر، انرژی فعالسازی رفت از انرژی فعالسازی برگشت، بیشتر است.
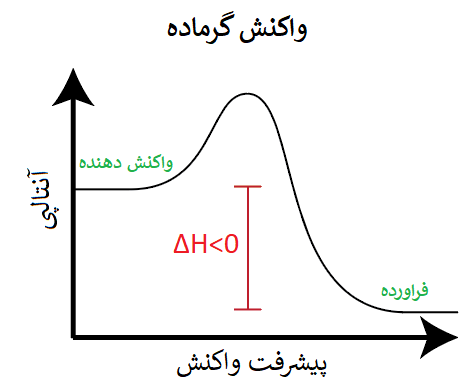
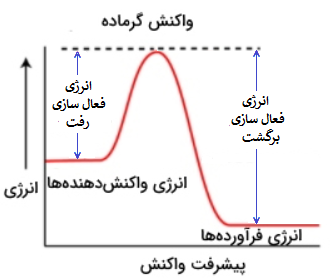
در واکنشهای گرماده به این دلیل که واکنش، گرما از دست داده است؛ سطح انرژی فرآوردهها از سطح انرژی واکنش دهندهها کمتر (پایینتر) است:
از طرفی هرچه سطح انرژی کمتر باشد، مواد پایدارتر هستند و تمایل آنها برای تغییرات کمتر است، در نتیجه جدا کردنشان از همدیگر سختتر است؛ به همین دلیل در یک واکنش گرماده (که سطح انرژی واکنش دهندهها بالاتر از سطح انرژی فرآوردههاست) انرژی فعال سازی تبدیل واکنش دهندهها به فرآوردهها از انرژی فعال سازی تبدیل فرآوردهها به واکنش دهندهها کمتر است، پس با توجه به توضیحات داده شده:
در یک واکنش گرماگیر، انرژی فعالسازی رفت از انرژی فعالسازی برگشت، کمتر است
یک نظر
چون واکنش سوختن داریم واکنش گرماده می باشد و انرژی فعال سازی فقط برای رفت لازم است