سوال 92دفترچۀتجربی(سوال 17 شیمی)،اردیبهشت1404
اگر آنتالپی سوختن ترکیب آلی با فرمول مولکولی CnH2n+2O برابر 1360 کیلوژول بر مول باشد و از سوختن 11.5 گرم از آن، 340 کیلوژول گرما آزاد شود، این ترکیب کدام و فرمول مولکولی آن، دارای چند ساختار متفاوت است؟ (H=1,C=12,O=16:g⋅mol−1)
1) C2H6O ، دو
2) C3H8O ، دو
3) C2H6O ، یک
4) C3H8O ، یک
پاسخ:
جرم مولی این ترکیب برابر است با:
CnH2n+2O=12n+2n+2+16=14n+18g⋅mol−1
حال با یک تناسب ساده میتوان به n و فرمول ترکیب رسید، از آنجایی که آنتالپی سوختن یک مول (یا 14n+18 گرم) این ترکیب برابر با 1360kJ بوده و آنتالپی سوختن 11.5 گرم آن، برابر 340kJ هست، میتوان نوشت:
| جرم(g) | آنتالپی سوختن(kJ) |
| 14n+18 | 1360 |
| 11.5 | 340 |
در نتیجه n=2 به دست میآید، و فرمول آن به صورت C2H6O خواهد بود، با این فرمول مولکولی میتوان دو ساختار اتانول و دیمتیلاتر به صورت زیر داشت:
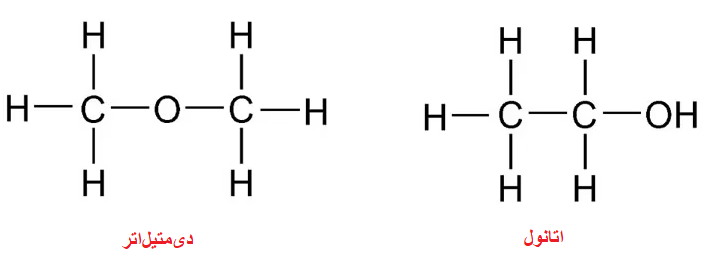
بنابراین پاسخ گزینۀ 1 هست.
پیش نیاز لازم برای پاسخ به این تست:
- آشنایی با مبحث آنتالپی سوختن
- احاطه بر ایزومر و ساختار ترکیبات آلی
تحلیل سوال:
- در این تست با دانستن استوکیومتری و رسم ساختار آلی و آنتالپی سوختن شاهد یک تست ترکیبی با زمان پاسخدهی استاندارد بودیم.
بخش زیبای تست:
- بخش ایزومر تست برای بررسی تعداد ساختارهای ممکن از زیباییهای این تست بود.
بخش دوست نداشتنی تست:
- ندارد، تست استانداردی بود.
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

