با هم بیندیشیم صفحه26 شیمی دوازدهم
1- آزمایشهای دقیق نشان میدهند که آب خالص رسانایی الکتریکی ناچیزی دارد. این ویژگی بیانگر وجود مقدار بسیار کمی از یونهای هیدرونیوم و هیدروکسید است. در واقع در یک نمونه از آب خالص شمار بسیار ناچیزی از مولکولهای H₂O به یونهای +H3O و −OH یونیده میشوند. جالب این است که اندازهگیریها و یافتههای تجربی در دمای اتاق برای آب و محلولهای آبی رابطه زیر را تأیید میکنند:
[H+][OH−]=10−14
آ) غلظت یونهای هیدرونیوم و هیدروکسید را در دمای اتاق برای آب خالص حساب کنید.
پاسخ:
[H+][OH−]=10−14
[H+]=[OH−] : خنثی
[H+]2=10−14
[H+]=10−7
[OH−]=10−7
ب) pH آب خالص و محلولهای خنثی را در دمای 25oC حساب کنید.
پاسخ:
[H+]=10−7
pH=−log[H+]
pH=−log(10−7)=7
2- شکل زیر تغییر غلظت یونهای هیدرونیوم و هیدروکسید را هنگام افزودن هر یک از مواد 1 , 2 به آب خالص نشان میدهد. با توجه به آن به پرسشها پاسخ دهید:
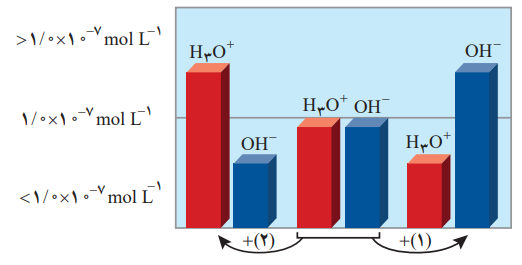
آ) کدامیک از مواد افزوده شده اسید آرنیوس است؟ چرا؟
پاسخ:
مادۀ 2، زیرا افزودن آن باعث افزایش غلظت یون هیدرونیوم (+H3O) میشود و طبق نظریه آرنیوس هر مادهای که غلظت یون هیدرونیوم را در آب افزایش دهد، اسید است.
ب) غلظت یونهای هیدرونیوم و هیدروکسید را در محلول بازی با یکدیگر مقایسه کنید.
پاسخ:
در محلول بازی (شکل سمت راست) غلظت یون هیدروکسید بیشتر از غلظت یون هیدرونیوم میباشد:
[OH–]>[H3O+]
پ) آیا میتوان گفت در محلولهای اسیدی، یونهیدروکسید وجود ندارد؟ توضیح دهید.
پاسخ:
خیر، در هیچ محلولی، غلظت یون هیدرونیوم یا هیدروکسید برابر با صفر نیست، زیرا در صورت برابر بودن یکی از این یونها رابطۀ زیر دیگر نمیتواند برقرار باشد:
[H+][OH−]=10−14
3- گروهی از دانشآموزان برای نمایش تغییر غلظت یونهای هیدرونیوم و هیدروکسید در محلولهای آبی و دمای اتاق، الگوی زیر را طراحی کردهاند. جاهای خالی را پرکنید و اساس کار آنها را توضیح دهید:
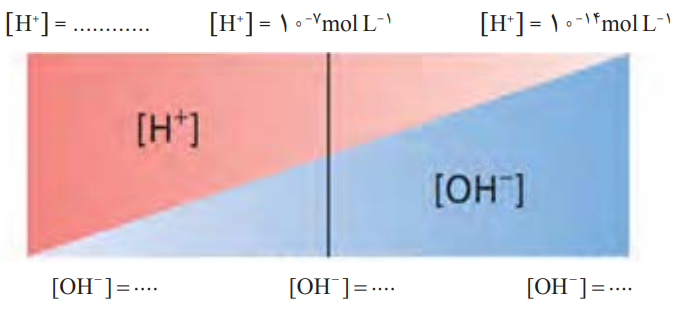
پاسخ:
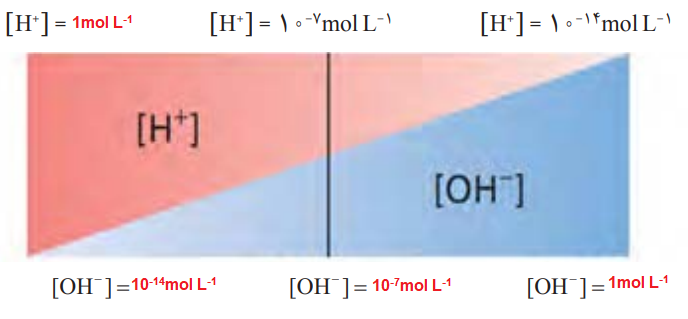
توضیح: با توجه به اینکه بازۀ pH از 0 تا 14 میتواند باشد پس خواهیم داشت:
[H+]=10-pH
pH=0 => [H+]=100 =1 : کاملا اسیدی
[H+][OH−]=10−14
1×[OH−]=10−14 => [OH−]=10−14
pH=14 => [H+]=10-14 : کاملا بازی
[H+][OH−]=10−14
10-14 ×[OH−]=10−14 => [OH−]=1
4- در نمودار زیر برای محلول آمونیاک، ستون نشاندهنده غلظت یونهیدروکسید و برای اسید معده، ستون نشاندهنده غلظت یونهیدرونیوم را رسم کنید.
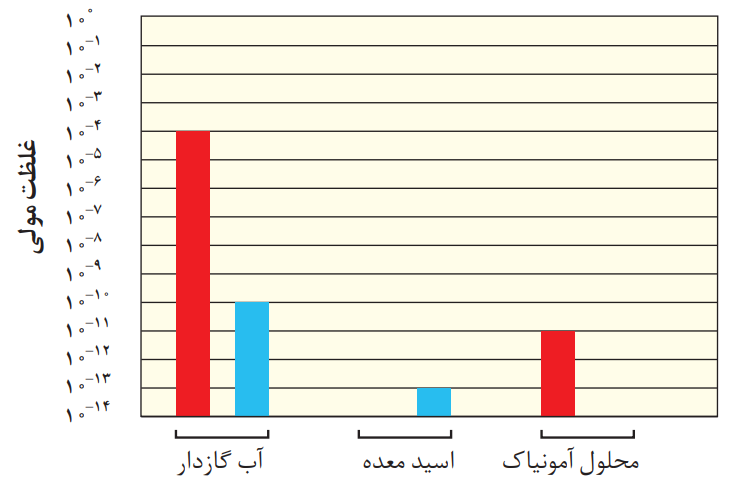
پاسخ:
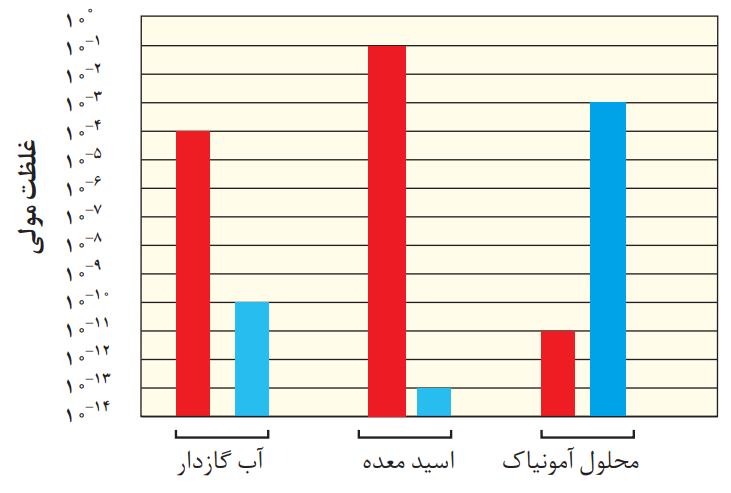
توضیح:
با توجه به رابطه زیر خواهیم داشت:
[H+][OH−]=10−14
آب گازدار:
[H+]=10-4 & [OH−]=10-10
در نتیجه:
10-4 ×10-10 =10−14
اسید معده:
[H+]=? & [OH−]=10-13
در نتیجه:
[H+] ×10-13 =10−14
[H+]=10−1
محلول آمونیاک:
[H+]=10-11 & [OH−]=?
در نتیجه:
10-11 ×[OH−] =10−14
[OH−]=10−3
برای درک بهتر خودآزمایی بالا، این پست را مطالعه فرمایید یا در این آزمون رایگان شرکت کنید.

