سوال 87دفترچۀتجربی(سوال 12 شیمی)،اردیبهشت1404
با توجه به واکنشهای دادهشده، اگر درصد خلوص KMnO4 دو برابر درصد خلوص FeCO3 و بازده درصدی واکنش (II) 1.2 برابر بازده درصدی واکنش (I) و مولهای برابر از گازهای O2 و CO2 در دو ظرف جداگانه تشکیل شده باشد، به ازای استفاده از 63.2 گرم KMnO4 ناخالص در واکنش (I)، چند گرم FeCO3 ناخالص در واکنش (II) استفاده شده است؟ (ناخالصی در واکنش شرکت نمیکند و معادلۀ واکنشها موازنه شود.) (C=12,O=16,K=39,Mn=55,Fe=56:g.mol−1)
I) KMnO4(s)→K2MnO4(s)+MnO2(s)+O2(g)
II) FeCO3(s)→Fe2O3(s)+CO2(g)+CO(g)
1) 58
2) 87
3) 29
4) 16
پاسخ:
ابتدا هر دو واکنش را موازنه میکنیم:
I) 2KMnO4(s)→K2MnO4(s)+MnO2(s)+O2(g)
II) 3FeCO3(s)→Fe2O3(s)+2CO2(g)+CO(g)
درصد خلوص KMnO4 را P1 و درصد خلوص FeCO3 را P2 و بازده درصدی واکنش I را R1 و بازده درصدی واکنش II را R2 فرض میکنیم، پس طبق اطلاعات تست خواهیم داشت:
P1=2P2
1.2R1=R2
از آنجایی که مولهای برابر از گازهای O2 و CO2 در دو واکنش تولید میشوند، میتوان با داشتن مقادیر خالص KMnO4 و FeCO3 با استفاده از استوکیومتری، به آنها رسید، پس برای به دست آوردن مقدار خالص آنها باید مقدار ناخالص داده شدۀ آنها را در درصد خلوص ضرب کنیم:
KMnO4(ناخالص)×P1=KMnO4(خالص)
FeCO3(ناخالص)×P2=FeCO3(خالص)
حال با استفاده از استوکیومتری طبق واکنش I خواهیم داشت:
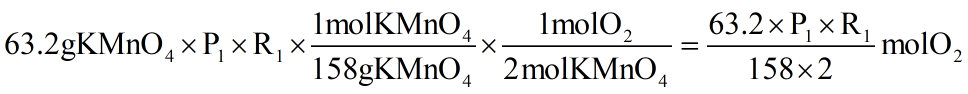
همچنین با استفاده از استوکیومتری طبق واکنش II خواهیم داشت:
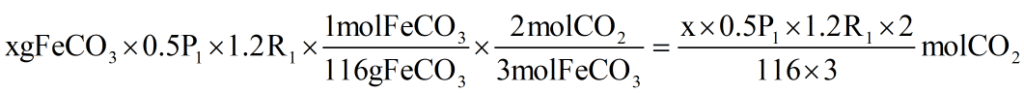
پس از آنجایی که مولهای برابر از گازهای O2 و CO2 در دو واکنش تولید میشوند، با برابر قرار دادن دو معادلۀ بالامقدار x (یا همان جرم FeCO3 ناخالص در واکنش II) را به دست میآوریم:
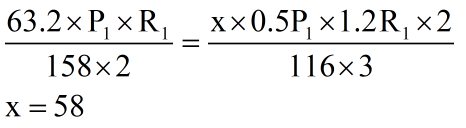
بنابراین پاسخ گزینۀ 1 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر استوکیومتری
- احاطه بر درصد خلوص و بازده درصدی
تحلیل سوال:
- استوکیومتری از مباحث پایه کنکور بوده که هر ساله، حدود 30 درصد کنکور به طور مستقیم و غیرمستقیم، حضور خود را در تستها نشان میدهد.
بخش زیبای تست:
- استفاده همزمان از درصد خلوص و بازده درصدی و نسبت دادن فراوردههای دو واکنش از زیباییهای این تست بود.
بخش دوست نداشتنی تست:
- با توجه به طولانی بودن تست، بهتر بود معادلات دو واکنش، موازنه باشند.
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

