پتانسیل کاهشی استاندارد را با ˚E نشان میدهیم و واحد آن ولت (v) میباشد.
به طور کلی ˚E یک ماده، تمایل آن ماده را به کاهش یافتن در یک واکنش مشخص میکند، و هرچه مقدار عددی ˚E بیشتر (مثبتتر) باشد، تمایل آن ماده به کاهش (گرفتن الکترون) در واکنش بیشتر است.
این مقدار عددی ˚E هر ماده را با استفاده از ˚E نیم سلول استاندار هیدروژن (SHE) به دست میآوریم؛ بدین صورت که ˚E نیم سلول استاندار هیدروژن را برابر با صفر قرار داده (SHE=0) و:
از آنجایی که فلزها برای شرکت در یک واکنش، تمایل به از دست دادن الکترون (اکسایش) دارند پس ˚E اغلب فلزها کمتر از SHE بوده و منفی هستند.
همچنین نافلزها برای شرکت در یک واکنش، تمایل به گرفتن الکترون (کاهش) دارند پس ˚E اغلب نافلزها بیشتر از SHE بوده و مثبت هستند.
البته برخی از فلزها تمایل به انجام واکنش ندارند، در نتیجه ˚E آنها را مثبت در نظر میگیریم، مانند: طلا (Au)، نقره (Ag)، پلاتین (Pt) ,…
در جدول زیر ˚E چند نیم سلول آورده شده که ترتیب آنها با توضیحات بالا همخوانی دارد:
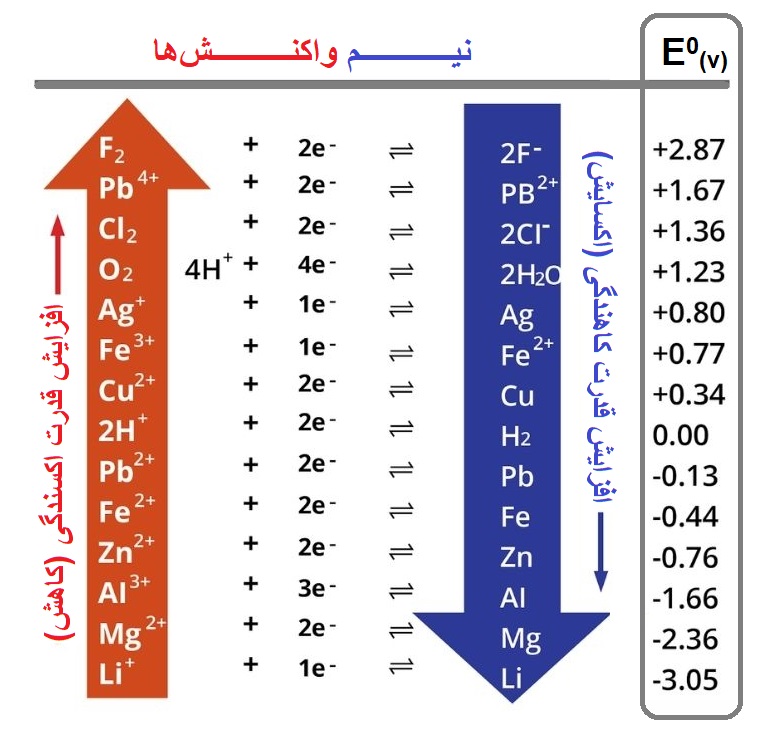
همان طور که در جدول بالا میبینیم، ˚E مواد از پایین به بالا افزایش مییابد، پس با توجه به تعریف ˚E ، تمایل مواد به کاهش یا گرفتن الکترون یا اکسندگی افزایش مییابد.
˚E زیاد : تمایل زیاد به کاهش: تمایل زیاد به گرفتن الکترون: تمایل زیاد به اکسندگی
˚E کم : تمایل زیاد به اکسایش: تمایل زیاد به از دست دادن الکترون: تمایل زیاد به کاهندگی
یک نظر
0.76-
چون از بالا به پایین در جدول قدرت کاهندگی افزایش می یابد