
برای درک بهتر تعریف بالا نیاز به چند یادآوری از پستهای قبل داریم:
حالا بریم سراغ یک مثال:
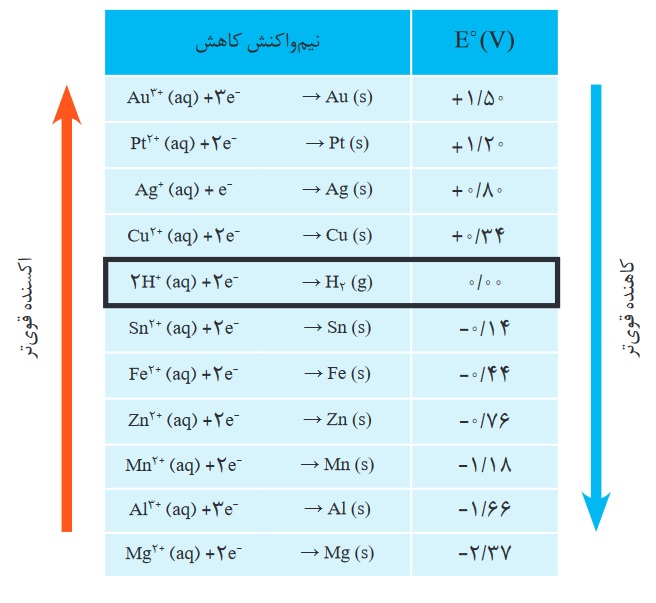
مثال: با توجه به جدول بالا، emf سلولی که واکنش زیر در آن رخ میدهد را حساب کنید:
Zn(s)+Cu2+(aq)→Zn2+(aq)+Cu(s)
پاسخ: با توجه به واکنش متوجه میشویم که:
عدد اکسایش روی (Zn) از صفر به 2+ افزایش یا اکسایش پیدا کرده است:
Zn(s)→Zn2+(aq)+2e : نیم واکنش اکسایش
عدد اکسایش یون مس (+Cu2) از 2+ به صفر کاهش پیدا کرده است:
Cu2+(aq)+2e→Cu(s) : نیم واکنش کاهش
پس الکترود روی (Zn) را که در آن اکسایش رخ داده، آند در نظر گرفته و الکترود مس (Cu) را که در آن کاهش انجام شده، کاتد در نظر میگیریم.
حال با توجه به جدول بالا °E نیم سلولهای روی و مس را پیدا میکنیم که به ترتیب برابر با: 0.76- و 0.34+ ولت هستند. پس با توجه به فرمول °Eسلول، emf این سلول را حساب میکنیم:

یک نظر
Mg:اکسایش یافته. (آند)
Ag:کاهش یافته. (کاتد)
3.17=(2.37-)-0.80+=Eسلول