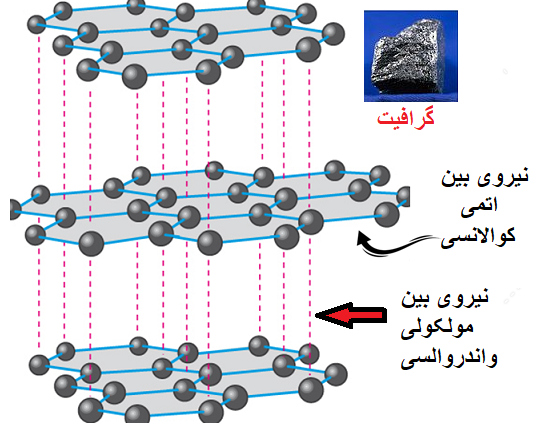
از پست پیوند کوالانسی میدانیم که اکثر موادی که نیروی بین اتمی کوالانسی است، مولکول تشکیل میدهند، و پیوند کوالانسی از اتصال نافلزها و همچنین شبه فلزها به همدیگر به وجود میآید.
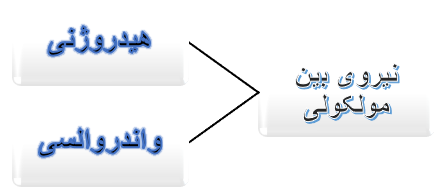
حال وقت آن است که تفاوت نیروهای بین مولکولی (یعنی پیوند هیدروژنی و نیروی واندروالسی) را متوجه شویم:
نیروی بین مولکولی هیدروژنی، برای شرایطی هست که اتم هیدروژن (H) از یک مولکول، به اتمهای FON (یعنی F فلوئور، O اکسیژن، N نیتروژن) در مولکول دیگر متصل شود، مطابق شکل زیر:
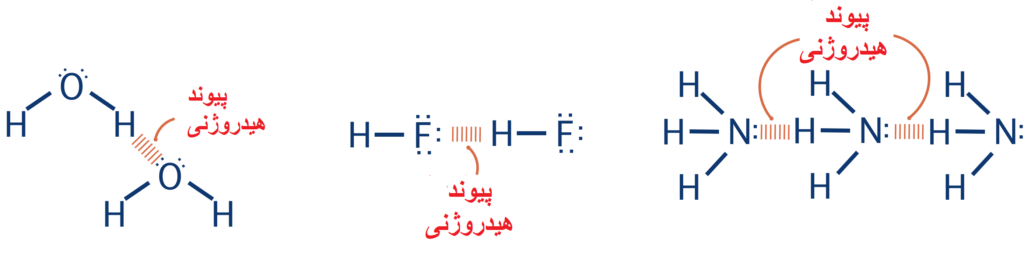
به عنوان مثال نیروی بین مولکولی آب هیدروژنی است، زیرا اتمهای آب (H2O) نافلز هستند پس نیروی بین اتمی آنها، کوالانسی محسوب میشود در نتیجه آب توانایی تشکیل مولکول را دارد (چون مولکول فقط در حالتی تشکیل میشود که نیروی بین اتمی، کوالانسی باشد)، حال از آنجایی که در مولکول آب، اتم هیدروژن (H) وجود دارد و این هیدروژن از مولکول اول به اکسیژن (O) در مولکول دوم وصل میشود، پس اسم این نیروی بین مولکولی، پیوند هیدروژنی هست؛ چون گفته شد اگر هیدروژن از یک مولکول به یکی از اتمهای FON (فلوئور، اکسیژن، نیتروژن) در مولکول دیگر وصل شود، آن پیوند بین مولکولی، هیدروژنی محسوب میشود.
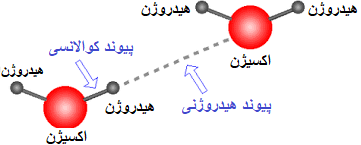
حال اگر نیروی بین مولکولی از نوع هیدروژنی نباشد به آن نیروی واندروالس گوییم، طبق شکل زیر که هر دو نوع نیروی مولکولی در آن قرار دارد:
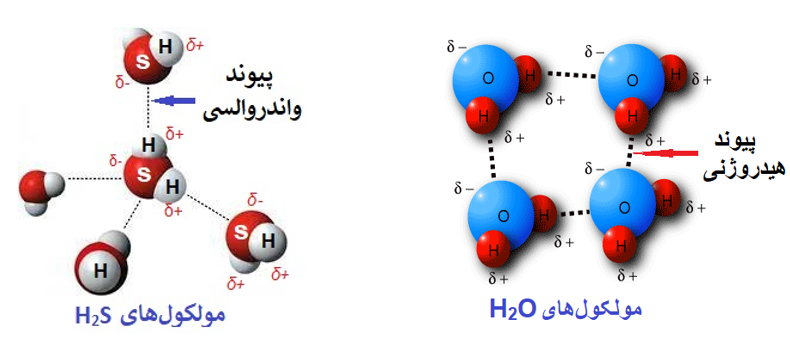
در شکل بالا با توجه به پست قطبیت پیوند کوالانسی میتوان متوجه علامتهای بار جزئی مثبت (δ+) و بار جزئی منفی (δ-) شد (چون همان طور که در آن پست گفته شد در پیوندهای کوالانسی در یک مولکول، نافلزی که قویتر است توزیع الکترون در اطراف آن بیشتر بوده و بار جرئی منفی میگیرد)
یک نظر
زیرا نیروی بین مولکولی هیدروژنی نیست یعنی یک هیدروژنژن به یکی از اتم های FON متصل نشده و در ضمن نیروی بین اتم ها کووالانسی است و چون اکثر پیوند های کوالانسی مولکول تشکیل میدهند پس بنابراین نیروی بین مولکولی از نوع واندروالس است