برای درک بهتر به واکنش فرضی زیر توجه کنید:
A+B→A++B–
همان طور که در واکنش بالا میبینیم، عدد اکسایش A از صفر به 1+ تغییر یافته، پس عدد اکسایش آن افزایش یافته یا اصطلاحا اکسایش پیدا کرده است، پس الکترون از دست داده است، چون اکسایش یعنی از دست دادن الکترون، پس:
A→A++e : نیم واکنش اکسایش
همچنین عدد اکسایش B از صفر به 1- تغییر یافته، پس عدد اکسایش آن کم شده یا اصطلاحا کاهش پیدا کرده است، پس الکترون گرفته است، چون کاهش یعنی گرفتن الکترون، پس:
B+e→B– : نیم واکنش کاهش
با توجه به توضیحات بالا، از آنجایی که گونۀ A الکترون از دست دادۀ خود را به B داده و باعث کاهشِ B شده است، به A نیز، کاهنده گوییم یا عامل کاهش B؛ از طرفی گونۀ B الکترون از دست رفته A را گرفته و باعث اکسایش A شده است، به B نیز، اکسنده گوییم یا عامل اکسایش A.
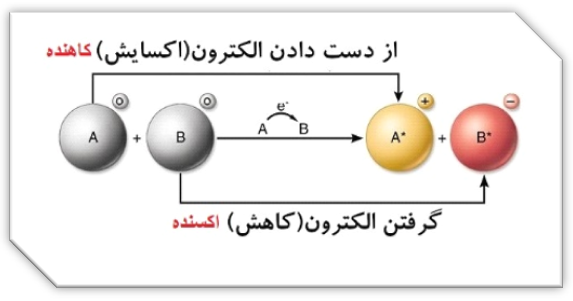
اکسایش: افزایش عدد اکسایش: از دست دادن الکترون: گونۀ کاهنده.
کاهش: کم شدن عدد اکسایش: گرفتن الکترون: گونۀ اکسنده.
یک نظر
Zn:اکسایش یافته پس(کاهنده)
O:کاهش یافته پس (اکسنده)