منظور از الکترود، جسم رسانایی است که انتقال دهنده جریان الکترون باشد.
برای درک بهتر به واکنش زیر توجه کنید:
Zn(s)+CuO(s)→ZnO(s)+Cu(s)
اعداد اکسایش مواد برابرند با:
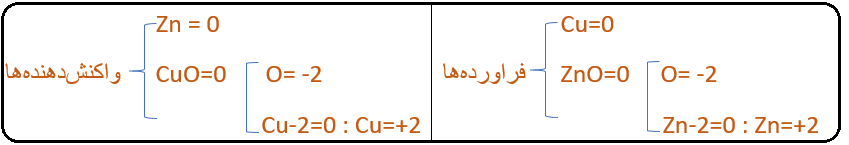
در واکنش بالا، عدد اکسایش روی (Zn) از صفر به 2+ افزایش یا اکسایش یافته است:
Zn(s)→Zn2+(aq)+2e :نیم واکنش اکسایش
همچنین عدد اکسایش یون مس (+Cu2) از 2+ به صفر کاهش یافته است:
Cu2+(aq)+2e→Cu(s) :نیم واکنش کاهش
حال به جایی که نیم واکنش اکسایش: Zn(s)→Zn2+(aq)+2e انجام میشود، آند گفته که همان فلز روی (Zn) است و جایی که نیم واکنش کاتد: Cu2+(aq)+2e→Cu(s) انجام میشود کاتد گوییم که همان فلز مس (Cu) میباشد.
آند: محل انجام نیم واکنش اکسایش و اکسایش یعنی از دست دادن الکترون یا افزایش عدد اکسایش
کاتد: محل انجام نیم واکنش کاهش و کاهش یعنی از گرفتن الکترون یا کم شدن عدد اکسایش
یک نظر
Ni:اکسایش یافته پس آند هست
Cu:کاهش یافته پس کاتد هست
با توجه به اولین توضیح این پست