از آنجایی که در قاعده ساختار لویس باید اطراف هر اتم 8 تا الکترون باشد (چه پیوندی، چه ناپیوندی) البته به جز هیدروژن که فقط 2 تا الکترون در اطراف آن میتواند وجود داشته باشد، ابتدا آن ساختار داده شده را هشتایی میکنیم و سپس شروع به شمارش الکترونهای پیوندی و ناپیوندی هر اتم با توجه به شماره گروه اصلی آن میکنیم و یادمان باشد که برای هر اتم همیشه شمارش را از الکترونهای ناپیوندی آن شروع میکنیم.
بیاییم برای درک بهتر، ادامه توضیح را روی یک مثال نشان دهیم:
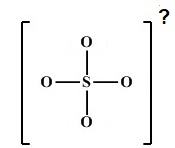
با توجه به ساختار یون سولفات، بار آن را میخواهیم مشخص کنیم:
در این ساختار در اطراف گوگرد 8 الکترون قرار دارد، زیرا دارای چهار پیوند میباشد و هر پیوند به معنای دو الکترون است؛ ولی از آنجایی که هر کدام از اکسیژنها فقط یک پیوند زدهاند، نیاز به ۶ الکترون یا سه جفت الکترون ناپیوندی دیگر دارند تا تعداد الکترونهای اطراف آنها به ۸ (قاعده هشتایی) برسد؛
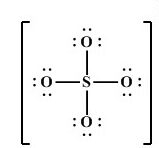
در ادامه تعداد الکترونهای پیوندی و ناپیوندی هر اتم باید با شماره گروه اصلی آن همخوانی داشته باشد؛ مثلا گوگرد در گروه 16 یا 6 اصلی جدول تناوبی قرار دارد، حال شمارش را اگر از گوگرد شروع کنیم پس از 8 تا الکترون اطراف گوگرد 6 تا را متعلق به آن میدانیم، از آنجایی که چهار پیوند اطراف آن است، اگر هر الکترون از پیوندهای سمت خودش را به اشتراک گذاشته باشد، پس تا اینجا ۴ الکترون گوگرد را پیدا کردهایم، در نتیجه میماند 2 الکترون دیگر گوگرد، که باید آنها را پیدا کنیم؛ اکسیژن هم در گروه ۶ قرار گرفته است؛ پس مجموعاً باید ۶ الکترون پیوندی و ناپیوندی داشته باشد، اما میبینیم که اطراف هر کدام از اکسیژنها فقط ۶ الکترون ناپیوندی قرار دارد؛ طبعا دیگر الکترونی برای به اشتراک گذاشتن با گوگرد و پیوند زدن ندارند. پس نتیجه میگیریم که گوگرد دو الکترون باقیمانده خود را به دو تا از اکسیژنها میدهد تا دو تا از 4 تا پیوندها برقرار شود. مطابق ساختار زیر:

اما هنوز 2 پیوند دیگر داریم که هر کدام از پیوندها، فقط یک الکترون از سمت گوگرد دارند و سمت اکسیژنها، الکترونی وجود ندارد تا پیوند کامل شود (زیرا میدانیم که هر پیوند دو الکترون لازم دارد) پس نیاز به دو الکترون خارجی داریم و این دو الکترون خارج از این ماده، بار این یون را 2- میکند، زیرا دو الکترون گرفتهایم:
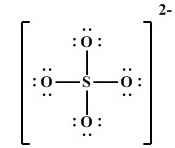
حالا بریم سراغ یک مثال دیگر از کتاب شیمیوم که هوشمند (اسم شاگرد) بار یون را مشخص میکند:
مثال: بار یون سیلیکات (SiO4) را با توجه به ساختار لویس آن مشخص کن.
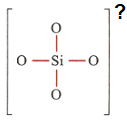
هوشمند: همان طور که گفتین اول چک میکنیم که اتمها قاعده هشتایی رو رعایت کردند یا نه. اول سیلسیم (Si) بررسی میکنم، به خاطر اینکه 4 تا پیوند زده، پس 8 تا الکترون اطرافش هس، و اکسیژنها چون هر کدوم فقط یه پیوند زدن (پس برای هشتایی شدن) هر کدوم 6 تا الکترون ناپیوندی باید بهش اضافه بشه، اینجوری:
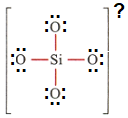
حالا که همشون هشتایی شدن، باید تعداد الکترونای هر اتم با شماره گروهش برابر باشه، سیلسیم که گروه چهار هس پس 4 تا الکترون داره، و چون 4 تا پیوند زده، میشه گفت الکترونهای پیوندای سمت خودش، کار خودش هس، به این صورت:
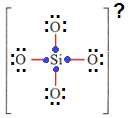
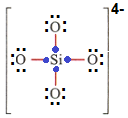
بعد اکسیژن چون گروه 6 اصلی هس پس 6 تا الکترون (چه پیوندی، چه ناپیوندی) باید داشته باشه، ولی اطراف همه اکسیژنها 6 تا الکترون ناپیوندی هس، پس دیگه الکترونی براشون نمیمونه که بخوان برای پیونداشون به اشتراک بذارن، از طرفی سیلسیم هم هر 4 تا الکترون خودش رو برای پیوندای سمت خودش گذاشت، پس برای هر پیوند ۱ الکترون کم داریم، که برای 4 تا پیوند 4 تا الکترون کم میاد، پس باید ساختار 4 تا الکترون بگیره که الکترونای پیونداش درست بشه، که بار ساختار میشه ۴ بار منفی.
اگر نیاز به یادآوری نحوه رسم ساختار لویس دارید این پست را بخوانید.