مورد اول) اگر مواد شرکت کننده در یک واکنش را، در عددی ضرب کنیم، آنتالپی آن واکنش را نیز باید در همان عدد ضرب کنیم، مثلا اگر مواد شرکت کننده در واکنش فرضی زیر را در 2 ضرب کنیم، آنتالپی واکنش نیز در 2 ضرب میشود:
a+b→c ΔH= -30kJ
2a+2b→2c ΔH=-60kJ
مورد دوم) اگر جای مواد واکنش دهنده و فراورده عوض شود، آنتالپی واکنش نیز در یک منفی ضرب میشود، مثلا:
a+b→c ΔH= -30kJ
c→a+b ΔH= +30kJ
مورد سوم) اگر چند واکنش را با هم جمع کنیم، آنتالپی آن واکنشها نیز، با هم جمع میشوند، مثلا در واکنشهای زیر، از مجموع واکنش 1 و 2، واکنش 3 به دست میآید، پس ΔH3 برابر با مجموع آنتالپیهای واکنشهای 1 و 2 خواهد بود:
1) a+b→c ΔH1= -30kJ
2) c+b→d ΔH2= -20kJ
ششششششششششششششش
3) a+2b→d ΔH3= ΔH1+ΔH2
ΔH3=-50kJ
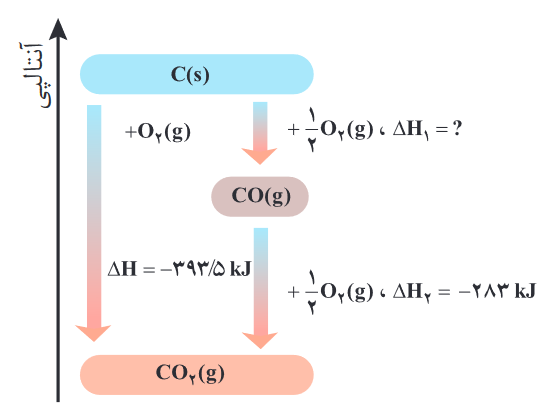
همان طور میبینیم قانون هس، برای به دست آوردن ΔH واکنشهای چند مرحلهای کابرد دارد، منظور از واکنشهای چند مرحلهای، آنهایی هستند که از مجموع چند وکنش دیگر به دست میآیند، مثلا در بالا واکنش 3، (a+2b→d)، یک واکنش دو مرحلهای محسوب میشود، زیرا از جمع دو واکنش دیگر به دست میآید.
حالا بریم سراغ مثال:
مثال: با استفاده از واکنشهای داده شده، آنتالپی واکنش: (l)H2(g)+O2(g)→H2O2 را به دست آورید:
1)H2(g)+0.5O2(g)→H2O ΔH= -286kJ
2)H2O2(l)→H2O(l)+0.5O2(g) ΔH= -196kJ
پاسخ: ابتدا باید با توجه به 3 موردی که گفته شد، فقط موادی در 2 واکنش داده شده را نگه داریم که در واکنش خواسته شده به آنها نیاز داریم، پس باید H2O حذف شود، زیرا تنها مادهای است که در واکنش اصلی وجود ندارد ولی در دو واکنش داده شده آن را میبینیم، از طرفی در واکنش خواسته شده H2 و O2 سمت واکنش دهندهها بوده و H2O2 در سمت فراوردهها قرار دارد، پس جای واکنش دهنده و فراورده واکنش 2 را عوض میکنیم تا H2O2 در سمت درست قرار گیرد، به این صورت آنتالپی واکنش 2 هم (طبق مورد2) در منفی ضرب میشود:
2)H2O(l)+0.5O2(g)→H2O2(l) ΔH= +196kJ
ولی واکنش 1 از آنجایی که نیاز به تغییرات ندارد و جای مواد در سمت خودشان درست است، به همان صورت داده شده مینویسیم:
1)H2(g)+0.5O2(g)→H2O ΔH= -286kJ
در آخر با جمع واکنشها، به واکنش خواسته شده میرسیم و آنتالپی واکنش خواسته شده، برابر خواهد بود با، مجموع آنتالپی دو واکنش اصلاح شده:
1)H2(g)+0.5O2(g)→H2O ΔH= -286kJ
2)H2O(l)+0.5O2(g)→H2O2(l) ΔH= +196kJ
شششششششششششششششششششش
H2(g)+O2(g)→H2O2(l) ΔH3= -286+196
ΔH3= -90kJ