با توجه به فرمول این غلظت، واحد آن برابر است با مول بر لیتر یا mol.lit-1
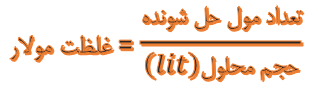
یکی از پرکاربردترین غلظتها در شیمی است.
به آن غلظت مولی نیز میگویند.
غلظت مولار را با M نیز نشان میدهند.
با توجه به واحدها در فرمول غلظت مولار (که صورت بر حسب مول و مخرج بر حسب لیتر است) به سراغ چند مثال میرویم.
همچون قبل فراموش نکنیم که محلول از حلال و حل شونده تشکیل شده است.
مثالها از کتاب شیمیوم آورده شده و به زبان خودمونی توضیح داده شده است:
مثال1: با حل شدن 2 مول هیدروفلوئوریک اسید در 800 میلی لیتر آب، غلظت اولیه این محلول به چند مول بر لیتر میرسد؟
چون واحد غلظت خواسته شده بر اساس مول بر لیتر هست پس غلظت مولار این محلول رو باید به دست بیاوریم غلظت مولار هم برابر است با تعداد مولهای حل شونده به روی حجم محلول بر اساس لیتر:
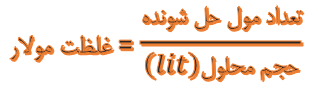
و چون حجم محلول را بر اساس میلی لیتر داده باید اول اونو تبدیل به لیتر کنیم که میشه 0.8 لیتر پس جواب میشه 2 تقسیم بر 0.8 که میشه 2.5 مول بر لیتر :

مثال2: برای داشتن 0.3 مولار KNO3 در ۲۰۰ میلی لیتر محلول آبی نیاز به چند گرم پتاسیم نیترات است؟ KNO3=150g/mol
چون سوال اسم کلمه مولار رو آورده پس داره در مورد غلظت مولار صحبت میکنه پس اول فرمول غلظت مولار رو مینویسیم که میشه تعداد مول حل شونده به روی حجم محلول بر حسب لیتر:
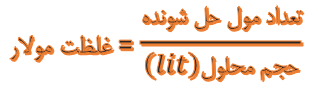
غلظت مولار رو که داده 0.3 و حجم محلول هم گفته 200 میلی لیتر که به لیتر تبدیلش میکنیم و میشه 0.2 لیتر، پس تعداد مول KNO3 میشه:

و چون سوال جرم 0.06molKNO3 رو خواسته با استفاده از جرم مولیش، گِرَمشرو به دست میارم، که میشه:
