هرچه نیروی بین مولکولی یک ترکیب بیشتر باشد، آن ترکیب مولکولی دارای نقطۀ جوش بالاتری است.
در ابتدا در مورد تاثیر پیوند هیدروژنی بر نیروهای بین مولکولی باید گفت:
مولکولهایی که دارای پیوند هیدروژنی هستند، نسبت به ترکیبات مولکولی مشابه خود، نقطه ذوب و جوش بالاتری دارند.
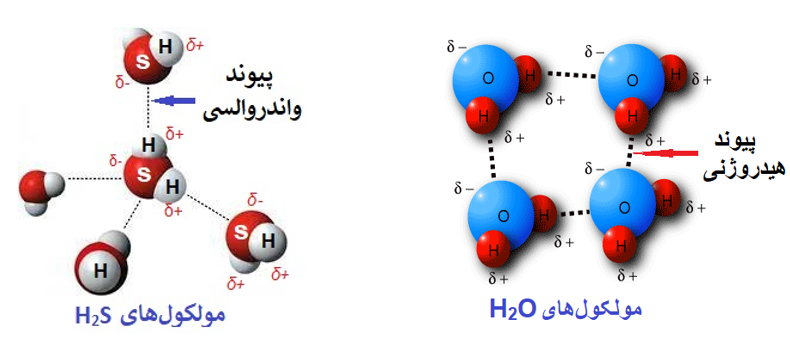
به عنوان مثال مولکول آب دارای نیروی بین مولکولی هیدروژنی است در نتیجه H2O از H2S (با توجه به آنکه گوگرد (S) در گروه اکسیژن (O) قرار دارد) دارای نقطه ذوب و جوش بسیار بالاتری است، زیرا H2O دارای نیروی بین مولکولی هیدروژنی است (چون یک هیدروژن از یک مولکول به اکسیژن از مولکول دیگر متصل است) اما H2S دارای نیروی بین مولکولی واندروالس است (زیرا هیدروژن به اتمهای فلوئور یا اکسیژن یا نیتروژن متصل نیست)
یا HF دارای نقطه ذوب و جوش بیشتری از HCl است، زیرا نیروی بین مولکولی HF هیدروژنی است، اما نیروی بین مولکولی HCl واندروالسی است.
اگر نیاز به یادآوری پیوند هیدروژنی و واندروالس دارید این پست را مطالعه فرمایید.
حال اگر خبری از نیروی بین مولکولی هیدروژنی نبود، مولکولی نسبت به ترکیبات مشابه خود دارای نقطه ذوب و جوش بالاتری است، که قطبیت بیشتری داشته باشد.
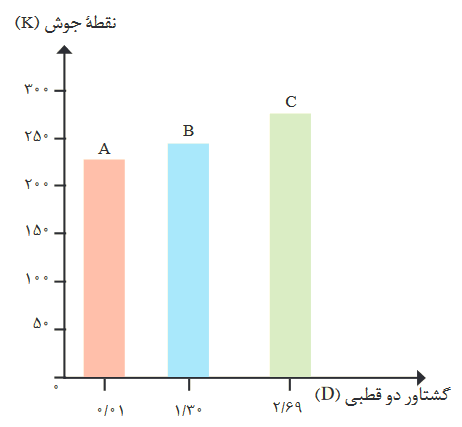
مثلا در نمودار زیر، بین مولکولهای A,B,C بیشترین نقطه جوش را ماده C دارد، زیرا بیشترین گشتاور دوقطبی یا قطبیت را دارد.
در پست گشتاور دوقطبی شیمی دهم نیز آموختیم هر چقدر یک مولکول قطبیتر باشد، گشتاور دوقطبی (μ) آن نیز بیشتر است.
اکنون به عنوان مثال اگر بخواهیم تشخیص دهیم کدام یک از مولکولهای پروپان (C3H8) یا دی متیل اتر (C2H6O) نقطه ذوب بالاتری دارند، از آنجایی که تقریبا دارای جرم مولی برابری هستند، پس مولکولی نقطۀ جوش بالاتری دارد که قطبی هست:
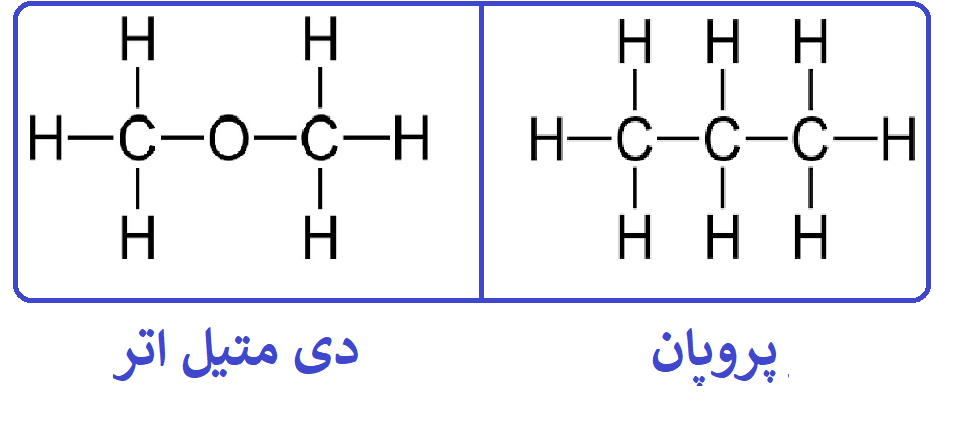
حال با توجه به ساختار لویس آنها از آنجایی که مولکول پروپان متقارن هست پس ناقطبی محسوب میشود، ولی مولکول دیمتیل اتر، چون اتمهای اطراف اتم مرکزی یکی نیستند پس نامتقارن و قطبی هست؛ پس دی متیل اتر نقطه جوش بالاتری نسبت به پروپان دارد.
نهایتا در صورتی که مولکولها ناقطبی بودند، آن مولکولی نسبت به ترکیبات مشابه خود، دارای نقطه ذوب و جوش بالاتری است که جرم مولی بیشتری داشته باشد.
مثلاً گاز کلر (Cl2) از گاز فلوئور (F2) دارای نقطه ذوب و جوش بالاتری هست زیرا زیرا هر دو ناقطبی بوده پس قدرت بین مولکولی آنها را با توجه به جرم مولیشان ارزیابی میکنیم، و از آنجایی که گاز کلر (Cl2) از گاز فلوئور (F2) جرم مولی بیشتری دارد پس دارای نقطۀ جوش بیشتری است. (جرم مولی گاز کلر: 71g/mol و جرم مولی گاز فلوئور: 38g/mol)
یک نظر
NH3 زیرا پیوند های مولکولی ای که دارای پیوند هیدروژنی هستند نسبت به ترکیبات مولکولی مشابه خود نقطه جوش بالاتری دارند