سرعت واکنش با تمامی موارد بالا، رابطۀ مستقیم دارد. مثلا هرچه سطح تماس بیشتر باشد، سرعت انجام واکنش بیشتر خواهد بود، برای درک بهتر به مثال زیر توجه کنید:
مثال: اگر منحنی C در نمودار زیر، نشان دهنده واکنش 0.5g نوار منیزیم با هیدروکلریک اسید در دمای اتاق طبق واکنش زیر باشد:
2HCl(aq)+Mg(s)→MgCl2(aq)+H2(g)
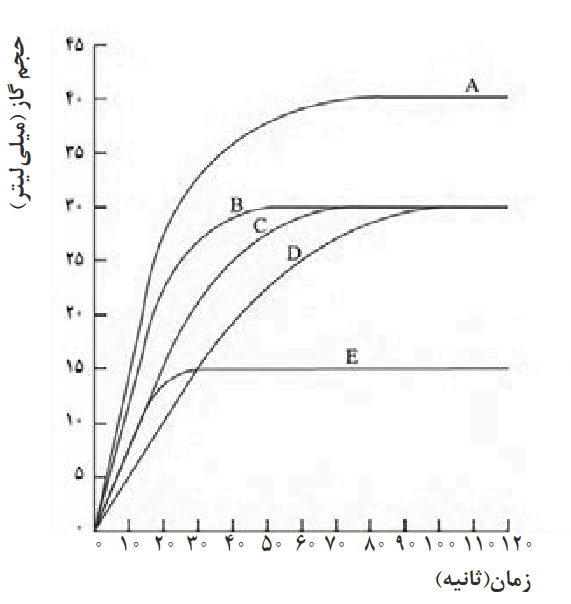
الف) کدام منحنی مربوط به واکنش 0.5g پودر منیزیم با هیدروکلریک اسید در دمای اتاق هست؟ (بقیه شرایط یکسان)
ب) کدام منحنی واکنش 0.5g نوار منیزیم با هیدروکلریک اسید در دمای 5 درجه سانتیگراد هست؟ (بقیه شرایط یکسان)
پاسخ:
الف) با توجه به اینکه شرایط تغییر نکرده و مقدار اولیه ماده همان است، پس طبق استوکیومتری مقدار نهایی نیز تغییر نخواهد کرد، در نتیجه پاسخ یکی از منحنیهای B یا C یا D خواهد بود، ولی از آنجایی که نوار منیزیم به پودر منیزیم تبدیل شده، پس سطح تماس منیزیم افزایش یافته، در نتیجه سرعت واکنش افزایش مییابد، پس پاسخ منحنی B هست (چون شیب بیشتری داشته، پس سرعت بیشتری دارد)
ب) با توجه به اینکه شرایط تغییر نکرده و مقدار اولیه ماده همان است، پس طبق استوکیومتری مقدار نهایی نیز تغییر نخواهد کرد، در نتیجه پاسخ یکی از منحنیهای B یا C یا D خواهد بود، فقط دما در قسمت ب نسبت به صورت سوال کاهش یافته است، و از آنجایی که سرعت با دما رابطۀ مستقیم دارد، در نتیجه سرعت واکنش در قسمت ب کاهش مییابد (چون دمای کمتری نسبت به صورت سوال دارد) در نتیجه پاسخ منحنی D خواهد بود.