شعاع یونی
به شعاع یک اتم، زمانی که تبدیل به یون میشود شعاع یونی گوییم:
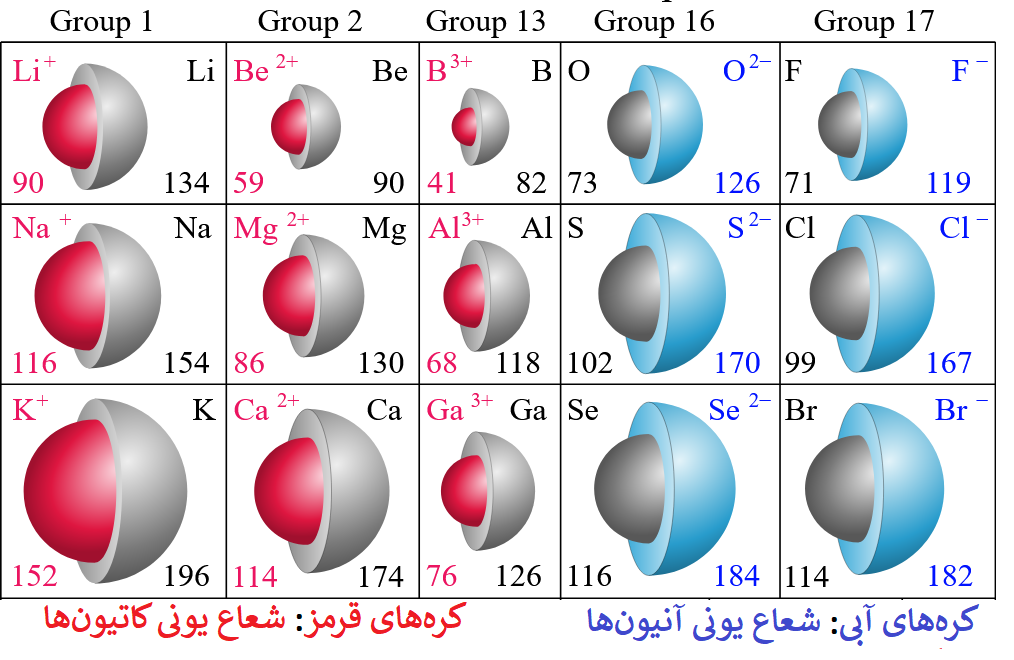
همان طور که در شکل بالا میبینیم:
- شعاع یونی کاتیونها (یونهای مثبت) کوچکتر از شعاع اتمی آنها (حالت خنثی) میباشد و دلیل آن واضح است، زیرا یک اتم با از دست دادن الکترون شعاع آن کوچکتر میشود.
- شعاع یونی آنیونها (یونهای منفی) بزرگتر از شعاع اتمی آنها (حالت خنثی) میباشد و دلیل آن نیز واضح است، زیرا یک اتم با گرفتن الکترون شعاع آن بزرگتر میشود.
در درسنامه شیمی دهم آموختیم که دلیل تبدیل شدن یک اتم خنثی به یون پایدار خود، رسیدن به نظم و پایداری یا آرامش است؛ و میدانیم گازهای نجیب جزو پایدارترین عنصرهای جدول دورهای هستند؛ حال یک اتم مانند سدیم (11Na) که در گروه اول جدول دورهای قرار گرفته، میخواهد پایدار شدن باید به آرایش نزدیکترین گاز نجیب به خود برسد که نئون (10Ne) است، پس باید یک الکترون از دست بدهد و تبدیل به یون +1 شود: +Na
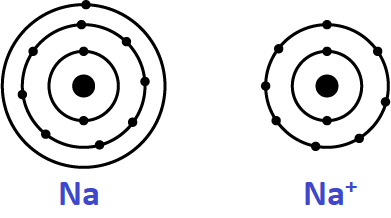
همان طور که در شکل بالا میبینیم، سدیم با از دست دادن 1 الکترون یک لایه، مدار الکترونی آن کم شده و شعاع آن کاهش قابل توجهی پیدا میکند.
متقابلا اتمی مانند کلر (17Cl) برای پایدار شدن باید به آرایش الکترونی گاز نجیب نزدیک به خود برسد (یعنی آرگون 18Ar) پس یک الکترون گرفته و تبدیل به –Cl میشود و شعاع آن نسبت به حالت خنثی افزایش مییابد.
نیاز به یادآوری است که شعاع اتمی در یک گروه از بالا به پایین افزایش مییابد و در یک دوره از چپ به راست کاهش مییابد ولی در رابطه با شعاع یونی باید دو مورد دیگر را نیز بدانیم:
مورد اول: یونهایی که به آرایش الکترونی کدام گاز نجیب متفاوت رسیدهاند) از آنجایی که در یک گروه از بالا به پایین، شعاع اتمی افزایش مییابد، پس هرچه یک یون به آرایش الکترونی گاز نجیبی با عدد اتمی بزرگتری رسیده باشد دارای شعاع یونی بزرگتری خواهد بود. به عنوان مثال یونی که به آرایش الکترونی آرگون (18Ar) رسیده باشد، شعاع یونی بزرگتری از یونی که به آرایش الکترونی نئون (10Ne) رسیده است خواهد داشت. زیرا آرگون پایینتر از نئون در گروه گازهای نجیب قرار دارد و همانطور که گفتیم در یک گروه از بالای پایین شعاع افزایش مییابد.
مورد دوم: (برای آن دسته از یونهایی است که به آرایش الکترونی گاز نجیب یکسان رسیده باشند). در این حالت یونی شعاع کوچکتری خواهد داشت که عدد اتمی بزرگتری داشته باشد؛ زیرا میدانیم هرچه عدد اتمی بزرگتر باشد، پس بار موثر هسته بیشتر خواهد بود و الکترونهای اطرافش را بیشتر به سمت خود میکشد، پس شعاع کوچکتر خواهد شد.
برای درک بهتر به مثال زیر توجه کنید:
مثال زیر از کتاب شیمیوم آورده شده که مدرس سوال را پرسیده و شاگرد، پاسخ داده است:
مثال: میتونی بگی بین یونهای 3Li+ , 11Na+ , 8O2- , 9F– 20Ca2+, و 16S2- ترتیب شعاع یونی آنها بر اساس اندازه به چه صورت هست؟
اجازه +3Li که به آرایش الکترونی هلیم (2He) میرسه، +11Na هم با از دست دادن یک الکترون به آرایش الکترونی نئون (10Ne) میرسه، 8O-2 هم با گرفتن دو تا الکترون به آرایش الکترونی نئون میرسه، –9F هم با گرفتن یک الکترون به آرایش الکترونی نئون میرسه، 20Ca+2 هم با از دست دادن دو تا الکترون به آرایش الکترونی آرگون (18Ar) میرسه، 2-16S هم با گرفتن دو تا الکترون به آرایش الکترونی آرگون میرسه، حالا چون تو مورد اول گفتین، هرچه یه یون به آرایش الکترونی یک گاز نجیب کوچکتر برسه شعاع کوچکتری داره پس کوچکترین شعاع مربوط به یون لیتیم (+3Li) میشه که به آرایش الکترونی هلیم (2He) رسیده، و –11Na+ , 8O2- , 9F هم به آرایش گاز نجیب نئون (10Ne) رسیدن، پس طبق مورد دوم که گفتین وقتی یونها به آرایش گاز نجیب یکسان میرسن، اون یونی که بیشترین عدد اتمی رو داره، شعاع کوچکتری داره؛ پس یون سدیم شعاع یونی کوچک تری نسبت به یون های اکسیژن و فلوئور داره، چون عدد اتمی بزرگتری داره؛ بعدشم یون فلوئور و بعد از اون یون اکسیژن؛ در مورد 20Ca+2 و 16S-2 هم که به آرایش الکترونی آرگون رسیدن، پس بزرگترین شعاع یونی رو دارن، چون شعاع اتمی گاز نجیب آرگون از نئون و هلیوم بزرگتره، و باز هم طبق مورد دوم چون عدد اتمی کلسیم از گوگرد بزرگتره، پس شعاع یونیش از گوگرد کوچکتره، و ترتیب نهایی شعاع یونیشون به این صورت میشه:
3Li+< 11Na+ < 9F– < 8O2- < 20Ca2+ < 16S2-
اگر نیاز به یادآوری روند تغییرات شعاع اتمی دارید این پست و اگر نیاز به یادآوری آرایش الکترونی فشرده را دارید این پست را مطالعه کنید.


یک نظر
Cl2