سوال101دفترچه (سوال 26 شیمی)رشته ریاضی، تیر 1403
250 میلیلیتر محلول هیدروکلریک اسید 0.2 مولار ، 100 میلیلیتر محلول پتاسیم هیدروکسید 0.1 مولار و 150 میلیلیتر محلول NaOH که در هر لیتر از آن، 4 گرم حلشونده وجود دارد، با یکدیگر مخلوط میشوند. به این محلول چند میلیلیتر آب مقطر اضافه شود تا pH محلول حاصل برابر 12 شود؟ (حجم محلولها جمعپذیر در نظر گرفته شود)
(Na=23 , O=16 , H=1 : g.mol-1)
- 1500
- 1250
- 750
- 500
پاسخ:
با توجه به مفهوم غلظت مولار که نسبت تعداد مول حل شونده به حجم محلول (بر حسب لیتر) است میتوانیم با داشتن حجم و غلظت اسید و بازها به مول آنها برسیم:
تعداد مول HCl:
0.2×0.25=5×10-2
تعداد مول KOH:
0.1×0.1=10-2
تعداد مول NaOH:
ابتدا 4 گرم را با جرم مولی آن، تبدیل به مول میکنیم:
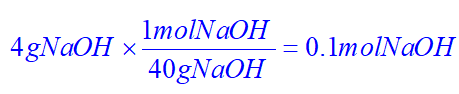
این 0.1 مول NaOH به ازای 1 لیتر از محلول آن است، پس برای 150 میلی لیتر از محلول آن خواهیم داشت:
0.1×0.150=1.5×10-2
پس تا اینجا مولهای اسید و بازها را به دست آوردیم، اکنون از واکنش آنها تا جای ممکن با هم خنثی شده و در آخر 2-10×2.5 مول اسید باقی میماند:
5×10-2mol(HCl)-10-2mol(KOH)-1.5×10-2mol(NaOH)=
2.5×10-2mol(HCl)
همچنین تا اینجا 500 میلی لیتر محلول داریم که شامل:
250ml(HCl)+100ml(KOH)+150ml(NaOH)
میشود.
حال برای اینکه pH محلول به 1.7 برسد با استفاده از فرمول زیر میتوانیم حجم آب اضافه شده را به دست آوریم:
Mα=10-pH
که M غلظت اسید HCl بوده و از آنجایی که این اسید قوی هست پس α=1 بوده و میتوان فرمول را به صورت زیر نوشت:
M=10-pH
در نتیجه:
M=10-1.7
M=2×10-2
از طرفی میدانیم که M غلظت اسید بوده و برابر است با تعداد مول اسید (2-10×2.5 ) به روی حجم کل (یعنی 500 میلی لیتر یا 0.5 لیتر، به اضافه حجم آب اضافه شده) و میتوان به این صورت حجم آب اضافه شده (VH2O) را به دست آورد:
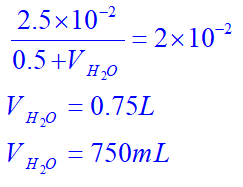
بنابراین جواب گزینه 3 هست.
پیش نیازهای لازم برای پاسخ به این تست:
- احاطه بر مبحث خنثی شدن اسیدها و بازها
- احاطه بر مبحث pH
- احاطه بر مبحث غلظت مولار
- آشنایی با استوکیومتری
تحلیل سوال:
با یک سوال مفهومی از مسائل اسیدها و بازها روبه رو بودیم که تاکید طراح آن، بر مبحث خنثی شدن بود.
بخش زیبای تست:
اینکه شاهد خنثی شدن کامل 1 اسید از 2 باز نبودیم از قسمتهای زیبای این تست بود و به طور کلی مشخص بود سوال توسط یک طراح کنکور مسلط بر شیمی معدنی طراحی شده است.
بخش دوست نداشتنی تست:
ندارد، تبریک به طراح تست.

