سوال100دفترچه (سوال 25 شیمی)رشته ریاضی، تیر 1403
با توجه به پتانسیل کاهشی استاندارد نیمسلولهای زیر، کدام واکنش در جهت طبیعی انجام نمیشود؟
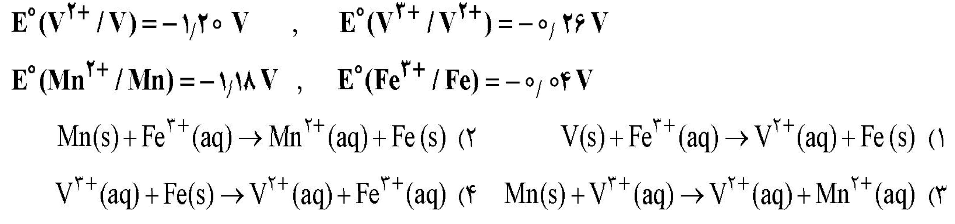
پاسخ:
برای اینکه یک واکنش اکسایش-کاهش در جهت طبیعی پیش رود باید E0 سلول مثبت شود و E0 سلول برابر با تفاضل E0 کاتد و E0 آند هست و فراموش نکنیم که گونه اکسایش یافته و گونه کاتد یافته را از روی واکنش پیدا میکنیم.
حال به سراغ گزینهها برویم:
1) V(s)+Fe3+(aq)→V2+(aq)+Fe(s)
اکسایش: V
کاهش: Fe3+
سلولE0= -0.04-(-1.20)=+1.16
پس به دلیل مثبت بودن E0 سلول این واکنش در جهت طبیعی انجام میشود.
2) Mn(s)+Fe3+(aq)→Mn2+(aq)+Fe(s)
اکسایش: Mn
کاهش: Fe3+
سلولE0= -0.04-(-1.18)=+1.14
پس به دلیل مثبت بودن E0 سلول این واکنش در جهت طبیعی انجام میشود.
3) Mn(s)+V3+(aq)→V2+(aq)+Mn2+(aq)
اکسایش: Mn
کاهش: V3+
سلولE0= -0.26-(-1.18)=+0.92
پس به دلیل مثبت بودن E0 سلول این واکنش در جهت طبیعی انجام میشود.
4) V3+(aq)+Fe(s)→V2+(aq)+Fe3+(aq)
اکسایش: Fe
کاهش: V3+
سلولE0= -0.26-(-0.04)=-0.22
به دلیل منفی بودن E0 سلول، این واکنش در جهت طبیعی انجام نمیشود.
بنابراین جواب گزینه 4 هست.
پیش نیازهای لازم برای پاسخ به این تست:
- احاطه بر مبحث اکسایش و کاهش
- احاطه بر مبحث E0
تحلیل سوال:
اهمیت به مفهوم انجام پذیری واکنشهای اکسایش-کاهش در جهت طبیعی با استفاده از E0 سلول از مطالب اصلی کنکور و مخصوصا امتحان نهایی هست.

