سوال 99 دفترچه (سوال 24 شیمی)تجربی، اردیبهشت1403
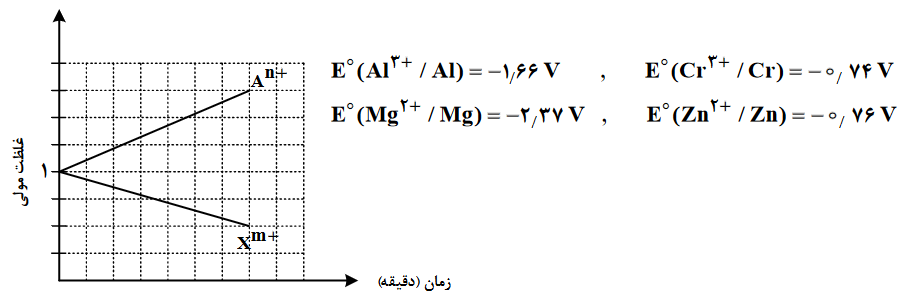
با توجه به نمودار دادهشده، که تغییرات غلظت یونها را در یک سلول گالوانی استاندارد نشان میدهد، کدام مورد درباره این سلول درست است؟ (A و X دو فلزند).
۱) A و X میتوانند بهترتیب، کروم و روی باشند و Cr3+(aq)، در سلول، نقش اکسنده را دارد.
۲) در این سلول گالوانی، بهازای مصرف 0.06 مول از فلز X، تعداد 1023×1.0836 الکترون مبادله میشود.
۳) نمودار میتواند مربوط به سلول گالوانی «منیزیم-آلومینیم» باشد که مقدار m،د1.5 برابر مقدار n، است.
۴) E⁰ الکترود (Xm+/X)، از E⁰ الکترود (An+/A) کوچکتر است و با گذشت زمان، از جرم تیغۀ A کاسته میشود.
پاسخ:
از نمودار درمییابیم که فلز A در حال اکسایش و یون +Xm در حال کاهش است، زیرا همیشه غلظت یون فلزی که اکسایش مییابد، زیاد میشود و غلظت یون فلزی که کاهش مییابد، کم میشود؛ از طرفی گونهای که اکسایش مییابد E⁰ کمتری نسبت به گونهای دارد که کاهش مییابد، پس E⁰ الکترود (An+/A)، از E⁰ الکترود (Xm+/X) کوچکتر است؛ و معادله اکسایش-کاهش به صورت زیر خواهد بود:
Xm+(aq)+A(s)→X(s)+An+(aq)
حال به سراغ گزینهها برویم:
۱) A و X میتوانند بهترتیب، کروم و روی باشند و Cr3+(aq)، در سلول، نقش اکسنده را دارد:
نادرست است، زیرا: طبق اطلاعات سوال، E⁰ روی، از E⁰ کروم، کمتر است، پس روی (Zn) اکسایش یافته و یون کروم (Cr3+(aq)) کاهش مییابد، در نتیجه فلز A نمیتواند کروم باشد، زیرا همان طور که گفته شد، فلز A طبق نمودارT اکسایش مییابد.
۲) در این سلول گالوانی، بهازای مصرف 0.06 مول از فلز X، تعداد 1023×1.0836 الکترون مبادله میشود:
نادرست است، زیرا: با توجه به معادلۀ واکنش که در ابتدای پاسخ آوردیم، فلز X در حال تولید شدن است، نه مصرف.
ولی بیاییم تعداد الکترونهای مبادله شده (با فرض تولید فلز X) را حساب کنیم:
از تغییرات نمودار میتوان نتیجه گرفت که ضریب استوکیومتری فلز A، از ضریب استوکیومتری فلز X، بیشتر است، زیرا غلظت تولید یون A از غلظت مصرف یون X بیشتر است، و از آنجایی که نسبت تغییرات نمودارها به صورت 3 به 2 است، پس برای اینکه ضریب استوکیومتری A بیشتر باشد باید ضریب 3 را به A داده و ضریب 2 را به X بدهیم و برای موازنه بار، m برابر با 3 و n برابر با 2 خواهد شد، پس واکنش کلی به صورت زیر است:
2X3+(aq)+3A(s)→2X(s)+A2+(aq)
پس نیم واکنش X2+/X به صورت زیر خواهد بود:
2X3++6e⇌2X
حال با استفاده از استوکیومتری به ازای مصرف 0.6 مول از فلز X، تعداد الکترون مبادله شده را به دست میآوریم:
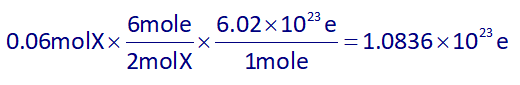
۳) نمودار میتواند مربوط به سلول گالوانی «منیزیم-آلومینیم» باشد که مقدار m،د1.5 برابر مقدار n، است:
درست است: طبق توضیحات گزینۀ 2، با توجه به اینکه n را 2 و m را 3 میتوان در نظر گرفت و منیزیم دارای بار +2 و آلومینیم دارای بار +3 هستند، از طرفی E⁰ آلومینیم از منیزیم بیشتر است، پس این گزینه میتواند درست باشد، همچنین با توجه به مقادیر m و n، مقدار m،د1.5 برابر مقدار n، است.
۴) E⁰ الکترود (Xm+/X)، از E⁰ الکترود (An+/A) کوچکتر است و با گذشت زمان، از جرم تیغۀ A کاسته میشود:
نادرست است، زیرا: فلز A در حال اکسایش و یون +Xm در حال کاهش است، و گونهای که اکسایش مییابد E⁰ کمتری نسبت به گونهای دارد که کاهش مییابد، پس E⁰ الکترود (An+/A)، از E⁰ الکترود (Xm+/X) کوچکتر است. ولی قسمت دوم گزینه که گفته شده: با گذشت زمان، از جرم تیغۀ A کاسته میشود، درست است؛ زیرا فلز A در واکنشی که نوشتیم در سمت واکنشدهندهها قرار دارد و مصرف میشود، پس از جرم تیغۀ آن کاسته میشود.
بنابراین پاسخ گزینۀ 3 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث سلولهای گالوانی
- احاطه بر مبحث سینتیک
- آشنایی با استوکیومتری
تحلیل سوال:
- شاهد یک تست تلفیقی از مباحث الکتروشیمی و سینتیک بودیم که تمرکز طراح تست بر روی مفاهیم این مباحث بود.
بخش زیبای تست:
- نمودار به زیبایی بار یونها را نمایش میداد و طراح خلاق تست از این مورد برای مجک داوطلبان در مبحث الکتروشیمی استفاده کرده بود. بحث تفاوت مصرف و تولید در گزینۀ 2، بحث تاثیر ضرائب استوکیومتری در گزینه 2 و 3 از زیباییهای این تست بود.
بخش دوست نداشتنی تست:
- تست زیبایی بود، تبریک به طراح خلاق این تست.

