سوال 98 دفترچه (سوال 23 شیمی)تجربی، اردیبهشت1403
در دمای ثابت، 5.4 گرم اسید ضعیف HX و 3 گرم اسید ضعیف HY در دو ظرف جداگانه، بهترتیب در 2 و 1 لیتر آب مقطر حل میشوند. اگر [–X] با [–Y] برابر باشد، کدام مورد درباره آنها نادرست است؟
(HX = 60 , HY = 50 : g.mol⁻¹)
۱) در واکنش مقدار کافی فلز منیزیم با محلولهای اسیدی، حجم گاز هیدروژن تشکیلشده در محلول HY، کمتر است.
۲) pH و شمار یونهای دو محلول، برابر و Ka برای اسید HX، بزرگتر از Ka برای اسید HY است.
۳) غلظت مولکولها در محلول اسید HY، بیشتر از غلظت مولکولها در محلول اسید HX است.
۴) غلظت یون هیدروکسید در محلول HX، برابر غلظت همین یون در محلول HY است.
پاسخ:
با توجه به برابر بودن غلظت آنیونهای اسیدها، پس غلظت یون هیدرونیوم آنها نیز با هم برابر است، زیرا طبق معادله یونش اسیدهای تک پروتونی، غلظت یون هیدرونیوم و آنیونهای اسیدها برابر است:
HX(aq)⇌H+(aq)+X–(aq)
حال با توجه به برابر بودن غلظت یون هیدرونیوم هر دو اسید، پس pH آنها نیز با هم برابر است :
pH=-log[H+]
حال به سراغ گزینهها میرویم:
۱) در واکنش مقدار کافی فلز منیزیم با محلولهای اسیدی، حجم گاز هیدروژن تشکیلشده در محلول HY، کمتر است:
درست است، زیرا طبق معادلۀ واکنش اسیدهای HX و HY با فلز منیزیم خواهیم داشت:
2HX(aq)+Mg(s)→MgX2(s)+H2(g)
2HY(aq)+Mg(s)→MgY2(s)+H2(g)
با توجه به برابر بودن ضرائب استوکیومتری اسیدهای HX و HY در واکنش بالا، پس هرچه تعداد مول اسیدها بیشتر باشد، حجم گاز هیدروژن آزاد شده (H2) نیز بیشتر خواهد بود، در نتیجه با استفاده از جرم مولی آنها، مول هر یک را به دست میآوریم:
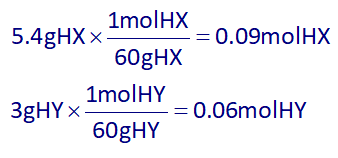
از آنجایی که تعداد مولهای اولیه HY کمتر از تعداد مولهای اولیه HX هست، پس اسید HY، حجم کمتری گاز هیدروژن آزاد میکند.
۲) pH و شمار یونهای دو محلول، برابر و Ka برای اسید HX، بزرگتر از Ka برای اسید HY است:
نادرست است، در مورد pH این گزینه درست است، زیرا طبق توضیحات ابتدای پاسخ با توجه به برابر بودن غلظت یون هیدرونیوم آنها، pH هر دو اسید با هم برابر است، ولی در مورد برابری شمار یونهای دو اسید، این گزینه غلط است، زیرا: اسید HX در یک ظرف 2 لیتری بوده ولی اسید HY در یک ظرف 1 لیتری است، ولی طبق سوال غلظت آنیونهای آنها برابر است، پس شمار یونهای اسید HX بیشتر از اسید HY است که با وجود 2برابر بودن حجم آن، غلظت یونهایش با غلظت یونهای اسید HY برابر است (هرچه حجم بیشتر باشد، غلظت کمتر خواهد شد):
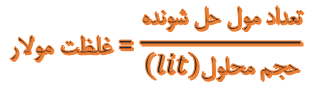
اما در مورد ثابت یونش (Ka)، این گزینه صحیح است، زیرا اسید HX به دلیل قدرت آزادسازی بیشتر یون هیدرونیوم، اسید قویتری نسبت به اسید HY بوده، پس Ka اسید HX از Ka اسید HY بیشتر است.
۳) غلظت مولکولها در محلول اسید HY، بیشتر از غلظت مولکولها در محلول اسید HX است:
درست است: با توجه به توضیحات گزینۀ 2، اسید HX از اسید HY قویتر بوده، پس مولکولهای اسید HX بیشتر تبدیل به یون شده (یونیده شده) و تعداد مولکولهای کمتری در پایان یونش خواهد داشت، پس غلظت مولکولها در محلول اسید HY، بیشتر از غلظت مولکولها در محلول اسید HX است.
۴) غلظت یون هیدروکسید در محلول HX، برابر غلظت همین یون در محلول HY است:
درست است: زیرا با توجه به رابطۀ زیر، از آنجایی که غلظت یون هیدرونیوم هر دو اسید با هم برابر است، پس غلظت یون هیدروکسید آنها نیز با هم برابر خواهد بود:
[H+][OH–]=10-14
بنابراین پاسخ گزینۀ 2 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث ثابت یونش و pH
- آشنایی با استوکیومتری
- احاطه بر مبحث غلظت مولار
تحلیل سوال:
- اسیدها و بازها با توجه به گسترده بودن مبحث آنها، نیاز به تسلط به تمامی قسمتهای آن میباشد که استوکیومتری و غلظتها، از پیشنیازهای مهم آن هستند.
بخش زیبای تست:
- بازی طراح خلاق این تست با تفاوت مول و غلظت و pH، از زیباییهای این تست بود، تا جایی که گزینۀ 1 و 2، حتی برخی از اساتید کنکور را هم به شک انداخته بود (زیرا به اشتباه، به جای مول غلظت را در استوکیومتری لحاظ میکردند)
بخش دوست نداشتنی تست:
- تست زیبایی بود، تبریک به طراح خلاق این تست.

