سوال 96 دفترچه (سوال 21 شیمی)رشته تجربی، تیر 1403
اگر pH اسید HA با (α=0.1)، برابر 1.3 باشد، در چند میلیلیتر از این محلول 18.8 گرم اسید حل شده است؟
(HA=47g.mol−1)
۱) ۱۰۰
۲) ۲۰۰
۳) ۴۰۰
۴) ۸۰۰
پاسخ:
میدانیم:
Mα=10-pH
از آنجایی که:
- pH=1.3
- α=0.1
پس:
M(0.1)=10-1.3
0.1M=5×10-2
M=0.5mol.lit-1
این یعنی در هر لیتر از محلول، 0.5 مول از اسید HA وجود دارد، حال برای اینکه بدانیم 18.8 گرم از این اسید در چند میلی لیتر از این محلول است ابتدا باید 0.5 مول از اسید را (به ازای 1 لیتر محلول)، با استفاده از جرم مولی، به گرم تبدیل کنیم:

حال با توجه به اینکه در هر لیتر از محلول، 23.5 گرم از اسید HA وجود دارد، به راحتی مشخص میکنیم در چند میلی لیتر از این محلول، 18.8 گرم از این اسید وجود دارد:
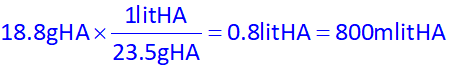
بنابراین جواب گزینۀ 4 خواهد بود.
پیش نیازهای لازم برای پاسخ به این تست:
- احاطه بر حل مسائل اسیدها
- آشنایی با استوکیومتری
تحلیل سوال:
- با یکی دیگر از مسائل اسیدها روبهرو بودیم که درحد متوسط بود.
بخش زیبای تست:
- مختصر بودن سوال بسیار به چشم میآمد.
بخش دوست نداشتنی تست:
- ندارد، فقط میتوان با اضافه کردن یک اسید دیگر و ارتباط بین آنها، تست را مفهومیتر کرد.

