سوال 95 دفترچه (سوال 20 شیمی)تجربی، اردیبهشت1403
اگر در دمای معین و در ظرف جداگانه، غلظت تعادلی HF در محلول، دو برابر غلظت تعادلی استیک اسید در محلول و pH محلول هیدروفلوئوریک اسید، برابر 1.3 باشد، تفاوت جرم آنیون در محلول آنها، برابر چند گرم است؟ (حجم هر یک از محلولها، برابر یک لیتر است، H=1 ، F=19 ، C=12 : g.mol⁻¹)
HF(aq) ⇌ H⁺(aq) + F⁻(aq) ، Kₐ = 5×10⁻4
CH₃COOH(aq) ⇌ H⁺(aq) + CH₃COO⁻(aq) ، Kₐ = 1.6×10⁻6
1) 0.832
2) 0.862
3) 0.880
4) 0.780
پاسخ:
با استفاده از فرمول ثبات یونش، و داشتن pH محلول HF، ابتدا غلظت آنیون –F را به دست آورده و با توجه به دو برابر بودن غلظت تعادلی HF نسبت به غلظت تعادلی CH₃COOH، غلظت یون ⁻CH₃COO را نیز به دست میآوریم؛
ابتدا با توجه به اینکه pH محلول HF برابر با 1.3 هست، پس غلظت یون هیدرونیوم آن برابر خواهد بود با:
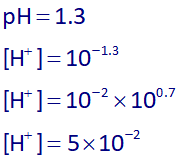
حال ثابت یونش HF را مینویسیم:
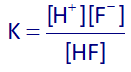
با توجه به استوکیومتری، غلظت یون فلوئورید نیز برابر با غلظت یون هیدرونیوم خواهد بود، پس غلظت تعادلی HF برابر است با:
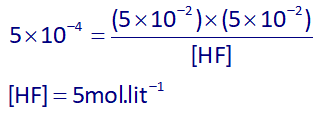
اکنون با توجه به دو برابر بودن غلظت تعادلی هیدروفلوئوریک اسید (HF) نسبت به غلظت تعادلی استیک اسید (CH₃COOH)، پس غلظت تعادلی استیک اسید برابر است با:
5÷2=2.5mol.lit-1
پس غلظت آنیون آن (⁻CH₃COO) با توجه به ثابت یونش این اسید، برابر خواهد بود با:
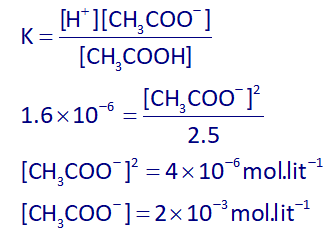
با توجه به 1 لیتری بودن حجم ظرف، پس غلظت مواد با مول آنها، برابر خواهد بود، پس در آخر با توجه به جرم مولی آنها، جرم هر کدام را به دست آورده و از هم کم میکنیم:
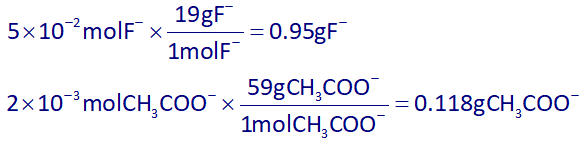
0.95-0.118=0.832g
بنابراین پاسخ گزینۀ 1 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث pH و ثابت یونش
- آشنایی با نام مواد
تحلیل سوال:
- برای تسلط بر مبحث اسیدها و بازها، باید مباحث غلظت، استوکیومتری، نام مواد را یاد گرفته باشیم.
بخش زیبای تست:
- ارتباط دادن معادله یونش دو اسید از زیباییهای این تست بود.
بخش دوست نداشتنی تست:
- ندارد، تست استانداردی بود.

