سوال 91 دفترچۀریاضی(سوال 16 شیمی)،اردیبهشت1403
از سوختن مقداری کربن، گازهای CO و CO2 تشکیل شده است. با توجه به واکنشهای زیر، اگر 5.6 لیتر گاز CO در شرایط STP تشکیل، و در مجموع 201.5 کیلوژول گرما آزاد شود، چند گرم کربن در واکنش (II) مصرف شده است؟ (C=12g.mol-1)
I) 2C(s)+O2(g)→2CO(g) , ΔH= -564kJ
II) C(s)+O2(g)→CO2(g) , ΔH= -393kJ
1) 8
2) 6
3) 4
4) 10
پاسخ:
مقدار ΔH داده شده در واکنش (I) به ازای سوختن 2 مول کربن و در واکنش (II) به ازای سوختن 1 مول کربن میباشد، پس با استفاده از استوکیومتری و مقدار گاز CO آزاد شده، میتوان مقدار کربن مصرفی در واکنش (I) را به دست آورد:
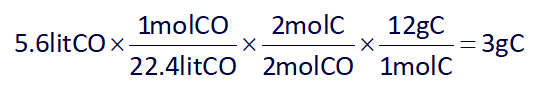
ΔH واکنش (I) به ازای سوختن 2 مول C میباشد، پس ΔH را برای 3 گرم C به دست میآوریم:
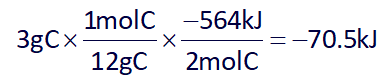
با توجه به صورت سوال که در مجموع 201.5 کیلوژول گرما آزاد میشود، و متوجه شدیم که ΔH واکنش اول را به دست آوردیم، پس ΔH واکنش دوم برابر است با:
-201.5-(-70.5)=-131kJ
حال با استفاده از ΔH واکنش دوم، مقدار کربن مصرفی در واکنش دوم را به دست میآوریم:
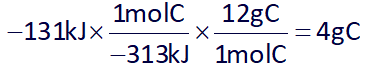
بنابراین پاسخ گزینۀ 3 هست.
پیش نیاز لازم برای پاسخ به این تست:
- آشنایی با مبحث ترموشیمی
- احاطه بر مبحث استوکیومتری
تحلیل سوال:
- گرماشیمی از مباحث همیشگی کنکور بوده که معمولا به صورت ترکیبی با سینتیک یا استوکیومتری تستهای کنکور را تشکیل میدهند.
بخش زیبای تست:
- ارتباط دادن آنتالپی واکنش با مقدار مصرفی یک واکنش دهنده از زیباییهای این تست بود.
بخش دوست نداشتنی تست:
- تست خلاقانهای بود، تبریک به طراح آن.
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

