سوال 88 دفترچه (سوال 13 شیمی)تجربی، اردیبهشت1403
آنتالپی سوختن متان، برابر k-890kJ.mol-1است. اگر گرمای حاصل از سوختن کامل 0.27 گرم اتان، دمای 780 گرم فلز آلومینیوم را 20 درجه سلسیوس افزایش دهد، از سوختن یک مول پروپان، چند کیلوژول گرما آزاد میشود؟
(C = 12 , H = 1 : g.mol⁻¹ , CAl = 0.9J.g-1.oC-1)
1) 2325
2) 2230
3) 2345
4) 2280
پاسخ:
ابتدا با استفاده از فرمول گرما، مقدار گرمای لازم برای افزایش دمای آلومینیوم را به دست میآوریم:
Q=mcΔθ
Q=780×0.9×20
Q=14040 J
طبق صورت سوال این مقدار گرما، معادل گرمای سوختن 0.27 گرم اتان (C2H6) است، پس با یک تناسب ساده، گرمای حاصل از سوختن 1 مول اتان را به دست میآوریم: (با توجه به اینکه 1 مول اتان، 30 گرم جرم دارد)

از آنجایی که آنتالپی سوختن گرماده است پس آنتالپی سوختن یک مول اتان برابر با 1560kJ- خواهد بود.
حال از آنجایی که اختلاف آنتالپی سوختن اتان (C2H6) و متان (CH4) برابر است با:
-1560-(-890)=-670kJ
پس میتوان گفت اختلاف آنتالپی سوختن پروپان (C3H8) و اتان (C2H6) نیز برابر با 670- خواهد بود:
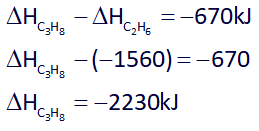
بنابراین پاسخ گزینه 2 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مفهوم گرما
- آشنایی با آنتالپی سوختن
- آشنایی با نام آلکانها
تحلیل سوال:
- ترموشیمی از مباحث اصلی کنکور بوده که تنوع سوالهای آن بسیار زیاد است، بنابراین داوطلبها باید به طور کاملا مفهومی با این فصل آشنا شوند.
بخش زیبای تست:
- ارتباط دادن گرمای حاصل از افزایش دمای آلومینیوم و آنتالپی سوختن اتان، بخش زیبای تست بود.
بخش دوست نداشتنی تست:
- بهتر بود در سوال ذکر میشد که افزایش آنتالپی سوختن آلکانها، خطی است.

