سوال 86 دفترچه (سوال 11 شیمی)رشته تجربی، تیر 1403
بر پایهی واکنشهای گرماشیمیایی دادهشده، تهیهی یک مول اتانول از تخمیر گلوکز (به حالت جامد)، چند کیلوژول انرژی آزاد میکند؟ (گاز کربن دیاکسید، فراوردهی دیگر واکنش است.)
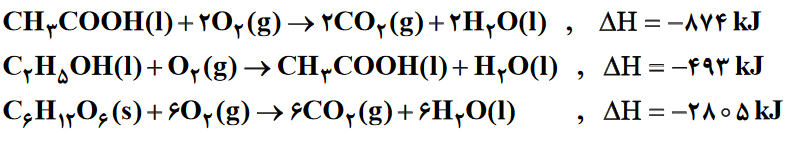
۱) 106.5
۲) 159
۳) 71
۴) 35.5
پاسخ:
با توجه به توضیحات صورت سوال، معادلۀ واکنش خواسته شده به صورت زیر خواهد بود:
C6H12O6(s)→C2H5OH(l)+CO2(g)
که با موازنه شدن به صورت زیر درمیآید:
C6H12O6(s)→2C2H5OH(l)+2CO2(g)
حال با استفاده از قانون هس و 3 واکنش داده شده، به این واکنش و آنتالپی آن میرسیم:
ابتدا برای اینکه بدانیم در مورد کدام واکنش صحبت میکنیم آنها را شمارهگذاری میکنیم:
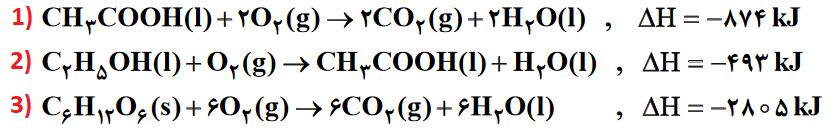
گلوکز (C6H12O6) در واکنش 3 با ضریب استوکیومتری صحیح و در سمت درست وجود دارد، پس تغییری در واکنش 3، ایجاد نمیکنیم، پس ΔH واکنش 3 تغییری نمیکند:
C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) , ΔH=-2805kJ
اتانول (C2H5OH) در واکنش 2 و در سمت واکنش دهندهها، با ضریب استوکیومتری 1 وجود دارد، پس باید واکنش 2 را معکوس کرده و آن را در عدد 2 ضرب کنیم تا اتانول هم در جای مورد نظر واکنش اصلی قرار گیرد، در این صورت ΔH واکنش 1 هم، در 2- ضرب میشود:
2CH3COOH(l)+2H2O(l)→2C2H5OH(l)+2O2(g) , ΔH=-493×-2=+986kJ
در آخر برای تصحیح کربن دی اکسید، باید واکنش 1 را معکوس کرده و در عدد 2 ضرب کنیم که در این صورت ΔH واکنش 1 هم، در 2- ضرب میشود:
4CO2(g)+4H2O(l)→2CH3COOH(l)+4O2(g) , ΔH=-874×-2=+1748kJ
حال از جمع 3 واکنش، به واکنش مورد نظرمیرسیم و ΔH واکنش مورد نظر برابر با مجموع ΔHهای هر 3 واکنش اصلاح شده است:
4CO2(g)+4H2O(l)→2CH3COOH(l)+4O2(g) , ΔH=1748kJ
2CH3COOH(l)+2H2O(l)→2C2H5OH(l)+2O2(g) , ΔH=986kJ
C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l) , ΔH=-2805kJ
————————————————————————————————.
C6H12O6(s)→2C2H5OH(l)+2CO2(g) , ΔH=1748+986+(-28050)
ΔH=-71kJ
این آنتالپی به دست آمده با توجه به واکنش کلی، به ازای 2 مول اتانول آزاد میشود، ولی صورت سوال، گرمای آزاد شده برای 1 مول اتانول را خواسته، پس:
-71÷2=-35.5kJ
پس پاسخ گزینه 4 خواهد بود، توجه داشته باشیم: دلیل اینکه ما پاسخ را 35.5- به دست آوردیم ولی در گزینه 4، علامت منفی قید نشده این است که در صورت سوال ذکر شده که چقدر گرما آزاد میشود و این یعنی گرماده بودن واکنش اصلی و تمام گزینهها علامت منفی دارند ولی نیازی به نوشتن آنها نیست.
پیش نیازهای لازم برای پاسخ به این تست:
- احاطه بر قانون هس
- آشنایی با نام مواد
- آشنایی با معادلۀ نویسی و موازنه
- آشنایی با استوکیومتری
تحلیل سوال:
- قانون هس یکی از مباحث مهم کنکور در تمامی سالها بوده و داوطلب باید در حل آن، مدیریت زمان را هم انجام دهد.
بخش زیبای تست:
- طراح این سوال با یک ایدۀ زیبا، واکنش اصلی را هم از خود داوطلب خواسته تا به دست آورد.
بخش دوست نداشتنی تست:
- ندارد؛ تبریک به طراح تست.

