سوال 85 دفترچۀریاضی(سوال 10 شیمی)،اردیبهشت1403
با توجه به معادله داده شده، اگر 3.95 گرم KMnO₄ با مقدار کافی محلول هیدرویدیک اسید واکنش دهد و 12.7 گرم مولکول دواتمی تشکیل شود، بازده درصدی واکنش کدام است؟
(معادله واکنش موازنه شود، O=16, K=39, Mn=55, I=127 : g.mol⁻¹)
KMnO4(s)+HI(aq)→ MnI2(aq)+H2O(l)+KI(aq)+I2(s)
1) 75
2) 80
3) 85
4) 90
پاسخ:
ابتدا معادله را موازنه میکنیم:
موازنه را از اتمی شروع میکنیم که کمترین تکرار را داشته باشد، پس در ابتدا سراغ اکسیژن میرویم که در سمت واکنش دهندهها 4تا بوده و در سمت فراوردهها یکی است، در نتیجه به H2O ضریب 4 میدهیم تا تعداد اکسیژن در طرفین برابر شود:
KMnO4(s)+HI(aq)→ MnI2(aq)+4H2O(l)+KI(aq)+I2(s)
اکنون هیدروژن را موازنه کرده که با دادن ضریب 8 به HI، تعداد هیدروژن در دو طرف برابر میشود:
KMnO4(s)+8HI(aq)→ MnI2(aq)+4H2O(l)+KI(aq)+I2(s)
در آخر به سراغ اتم ید (I) میرویم که بیشترین تکرار را در طرفین دارد. و با دادن ضریب 2.5 به I2 تعداد آن در دو طرف برابر شده:
KMnO4(s)+8HI(aq)→ MnI2(aq)+4H2O(l)+KI(aq)+2.5 I2(s)
در آخر برای اینکه ضریب استوکیومتری اعشاری نداشته باشیم تمامی ضریبها را در عدد 2 ضرب میکنیم:
2KMnO4(s)+16HI(aq)→ 2MnI2(aq)+8H2O(l)+2KI(aq)+5 I2(s)
حال با استفاده از استوکیومتری، مقدار نظری مولکول دو اتمی تشکیل شده (I2) را به دست میآوریم و در آخر با توجه به مقدار داده شدۀ آن در صورت سوال، بازده درصدی واکنش را محاسبه میکنیم:
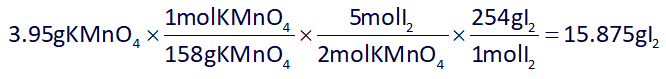

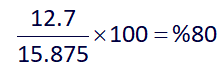
بنابراین پاسخ گزینۀ 2 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث موازنه
- احاطه استوکیومتری و بازده درصدی
تحلیل سوال:
- بار دیگر اهمیت استوکیومتری و موازنه را در کنکور متوجه شدیم که به طور مستقیم و آشنایی با بازده درصدی یکی از سوالهای کنکور را به خود اختصاص داده بود
بخش زیبای تست:
–
بخش دوست نداشتنی تست:
- میتوانست کمی خلاقانه باشد که با توجه به مدیریت زمان کنکور وجود چنین تستهایی لازم است.
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

