اگر در یک نمونه محلول با جرم 400 گرم، شمار مولهای آهن (III) برمید، دو برابر شمار مولهای آهن (III) سولفات بوده و 8.64 گرم یون سولفات در محلول وجود داشته باشد غلظت یون آهن (III)، به تقریب برابر چند ppm است؟
(O=16,S=32,Fe=56,Br=80:g.mol-1)
۱) 8400
۲) 16800
۳) 4200
۴) 2100
معادلۀ تفکیک آهن (III) برمید در آب:
FeBr3(aq)→Fe3+(aq)+3Br–(aq) واکنش1
معادلۀ تفکیک آهن (III) سولفات در آب:
Fe2(SO4)3(aq)→2Fe3+(aq)+3SO42-(aq) واکنش2
صورت سوال، جرم یون سولفات آزاد شده را داده، پس میتوان از طریق آن به مول آهن سولفات و مول آهنهای تولید شده برسیم:
در ابتدا با استوکیومتری مول یون آهن تولید شده در واکنش دوم را به دست میآوریم:
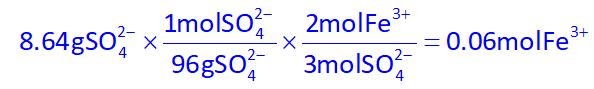
حال مول آهن (III) سولفات را محاسبه کنیم:
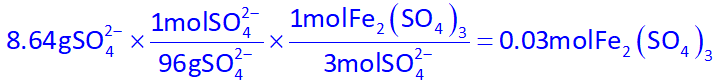
اکنون با توجه به صورت سوال که گفته شده شمار مولهای آهن (III) برمید، دو برابر شمار مولهای آهن (III) سولفات هست، پس تعداد مولهای آهن (III) برمید برابر با 0.06mol خواهد بود، در نتیجه با استفاده از آن، تعداد مول +Fe3 در واکنش اول را به دست میآوریم:
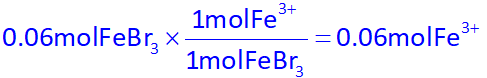
پس مجموع مولهای +Fe3 برابر خواهد بود با مجموع آنها در هر دو واکنش:
0.06molFe3+ + 0.06molFe3+ = 0.12molFe3+
و جرم مولی آن برابر خواهد بود با:
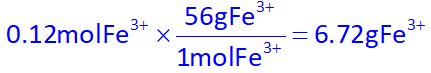
در نتیجه غلظت ppm آن میشود:
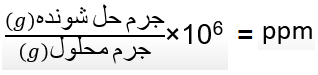
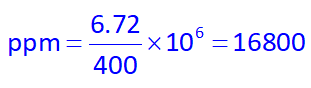
توجه اکثر داوطلبان کنکور در بحث غلظتها به مولار و جرمی است و به نوعی از غلظت ppm غافل میشوند، در این تست با ادغام مباحث غلظت و تفکیک نمکها و استوکیومتری طراح آن، به یک تست درخورِ کنکور 1403 رسیده است.
به طور کلی تستهایی که با کوتاهترین جملهها، بیشترین مفهوم را میرسانند تستهای زیبایی هستند که این مورد را در این تست کاملا حس میکنیم.
قسمت دوست نداشتنی ندارد؛ تبریک به طراح این تست، بابت سوال مفهومی و استاندارد.
این تست را میتوان از روشهای سریعتری حل کرد، منتها برای فهم بهتر، سعی شد که تا جای ممکن پاسخ را باز کنیم.