سوال 84 دفترچه (سوال 9 شیمی)رشته تجربی، تیر 1403
با توجه به معادلۀ زیر، اگر 13.8 گرم NaNO2 در واکنش با مقدار کافی محلول آمونیوم کلرید، 3.36 لیتر گاز نیتروژن تشکیل دهد، بازده درصدی واکنش کدام است؟ (جرم هر لیتر گاز در شرایط آزمایش، برابر 1.2 گرم است. معادله واکنش موازنه شود. N=14 O=16 Na=23 g.mol−1)
NH4Cl(aq)+NaNO2(aq)→N2(g)+H2O(l)+NaCl(aq)
۱) 82
۲) 72
۳) 62
۴) 42
پاسخ: ابتدا واکنش را موازنه میکنیم:
NH4Cl(aq)+NaNO2(aq)→N2(g)+2H2O(l)+NaCl(aq)
ابتدا مقدار گاز نیتروژن تولید شده را با استوکیومتری به دست میآوریم و
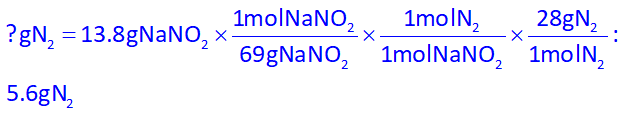
حال که جرم گاز نیتروژن تولیدی را به دست آوردیم، میتوانیم با توجه به توضیحات سوال (جرم هر لیتر گاز در شرایط آزمایش، برابر 1.2 گرم است) حجم گاز را نیز به دست آوریم:
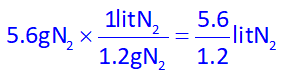
در انتها با توجه به مقدار داده شدۀ گاز نیتروژن تولیدی در صورت سوال، بازده درصدی واکنش را محاسبه میکنیم:
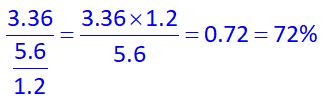
پس پاسخ گزینه 2 خواهد بود.
پیش نیازهای لازم برای پاسخ به این تست:
- احاطه بر استوکیومتری
- آشنایی با بازده درصدی
تحلیل سوال:
- از سری سوالهای مستقیم استوکیومتری که ادغامی از استوکیومتری جرمی و حجمی با درصد واکنش بود.
بخش زیبای تست:
- استفاده از ارتباط بین جرم و حجم (به جای حجم مولی) از ایدههای جالب این تست بود.
بخش دوست نداشتنی تست:
- ندارد؛ تست استانداردی بود ولی میتوانست مفهومیتر باشد.

