سوال 83 دفترچۀریاضی(سوال 8 شیمی)،اردیبهشت1403
200 گرم محلول 2.22 درصد جرمی کلسیم کلرید با مقدار کافی سدیم فسفات جامد واکنش کامل میدهد. اگر به محلول تشکیلشده، 1800 میلیلیتر آب مقطر اضافه شود، غلظت یون کلرید در پایان واکنش، پس از جدا کردن رسوب، برابر چند ppm است؟ (معادلۀ واکنش موازنه شود، از تغییر جرم محلول بر اثر انجام واکنش صرفنظر شود)
(Cl=35.5 , Ca=40 : g.mol-1)
CaCl₂(aq) + Na₃PO₄(aq) → Ca₃(PO₄)₂(s) + NaCl(aq)
1) 2840
2) 1420
3) 4260
4) 5680
پاسخ:
ابتدا معادله را موازنه میکنیم:
3CaCl₂(aq) + 2Na₃PO₄(aq) → Ca₃(PO₄)₂(s) + 6NaCl(aq)
حال با استفاده از استوکیومتری، تعداد مول NaCl را با توجه به 200 گرم محلول 2.22 درصد جرمی کلسیم کلرید، به دست میآوریم (چون محلول سمت فراوردهها NaCl(aq) است):

اکنون با توجه به معادلۀ یونش NaCl، جرم –Cl با توجه به 0.08 مول سدیم کلرید به دست آمده از استوکیومتری بالا، به دست میآوریم:
NaCl(aq)→Na+(aq)+Cl–(aq)
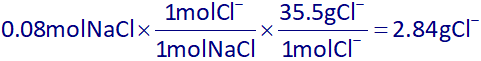
اکنون با توجه به اینکه رسوب (Ca₃(PO₄)₂(s)) از محلول جدا شده است، پس برای به دست آوردن غلظت ppm یون کلر، باید 2.84 گرم یون کلر را به جرم کل محلول تقسیم کنیم و سپس آن را در یک میلیون ضرب کنیم. جرم کل محلول هم برابر است با مجموع 200 گرم محلول اولیه و 1800 میلی لیتر آب مقطر که معادل 1800 گرم است:
200g+1800g=2000g
در نتیجه غلظت ppm یون کلر برابر است با:
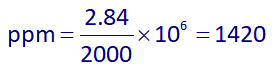
بنابراین پاسخ گزینۀ 2 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث استوکیومتری
- احاطه بر مبحث غلظت ppm
تحلیل سوال:
- استوکیومتری در ترکیب با سری تستهای غلظت، تنوع زیادی دارند که در اینجا با غلظت ppm ترکیب شده بود.
بخش زیبای تست:
- به طور کلی تست زیبایی بود. مشخص بود از ذهن یک مهندس طراحی شده بود، از بحث جدا سازی رسوب تا غلظت یون کلر
بخش دوست نداشتنی تست:
- ندارد. تبریک به طراح خلاق این تست.
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

