سوال 81دفترچۀتجربی(سوال 6 شیمی)،اردیبهشت1404
با توجه به واکنشهای دادهشده که در دو ظرف جداگانه و بهطور کامل انجام میشوند، اگر مجموع جرم کربن و PbO مصرفشده، برابر 2.71 گرم و جرم گاز گوگرد دیاکسید در واکنش (II)، 4 برابر جرم گاز هیدروژن تشکیلشده در واکنش (I) باشد، چند مول PbO در واکنش (II) شرکت کرده است؟
(H=1, C =12, O=16, S=32, Pb=207: g.mol-1)
I) H2O(g)+C(s)→CO(g)+H2(g)
II) 2PbO(s)+PbS(s)→3Pb(s)+SO2(g)
1) 0.005
2) 0.002
3) 0.010
4) 0.040
پاسخ:
با فرض اینکه با مصرف a گرم کربن (C)، مقدار x گرم گاز هیدروژن (H2) تولید شده و با مصرف b گرم PbO مقدار y گرم گاز گوگرد دی اکسید (SO2) تولید شده است، به سراغ استوکیومتری آنها میرویم:
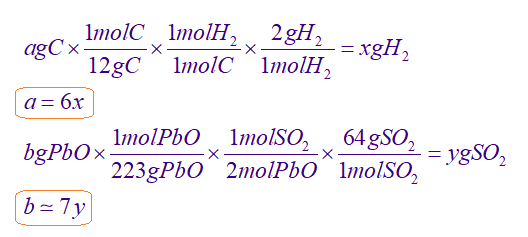
از طرفی با توجه به صورت سوال، مجموع جرم کربن و PbO مصرفشده، برابر 2.71 گرم میباشد، پس:
a+b=2.71
و جرم گاز گوگرد دیاکسید در واکنش (II)، 4 برابر جرم گاز هیدروژن تشکیلشده در واکنش (I) میباشد، پس:
y=4x
در نتیجه خواهیم داشت:
6x+7y=2.71
6x+28x=2.71
x=0.079
y=4x
y=0.318
b=7y
b=2.231
پس b که همان جرم PbO مصرفی هست برابر است با 2.231 گرم، حال با توجه به جرم مولی آن، مقدار مول مصرفی آن را به دست میآوریم:
$2.231 \, g \, PbO \times \frac{1 \, mol \, PbO}{223 \, g \, PbO}$=
0.01molPbO
بنابراین پاسخ گزینۀ 3 هست.
توجه: راه سریعتری برای رسیدن به پاسخ وجود دارد، ولی برای فهم همگانی این تست، از روش مرسوم کتاب درسی برای حل آن استفاده شده است.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر استوکیومتری
- آشنایی با نام مواد
تحلیل سوال:
- استوکیومتری از مباحث پایه کنکور بوده که هر ساله، حدود 30 درصد کنکور به طور مستقیم و غیرمستقیم، حضور خود را در تستها نشان میدهد.
بخش زیبای تست:
- تحلیل چهار مجهول که به هم مرتبط بودند از زیباییهای این تست بود
بخش دوست نداشتنی تست:
- تست زیبایی بود ولی میشد کمی در انتخاب اعداد برای محاسبات، ظرافتمندانهتر عمل کرد.
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

