سوال 79 دفترچه (سوال 4 شیمی)تجربی، اردیبهشت1403
با توجه به شکل داده شده که ظرفهای محتوی گازهای مختلف را در دما و فشار یکسان نشان میدهد، کدام مورد درست است؟ (هر ذره، معادل 0.1 مول است و He=4 , C=12 , N=14 , O=16 , Ne=20 : g.mol-1).
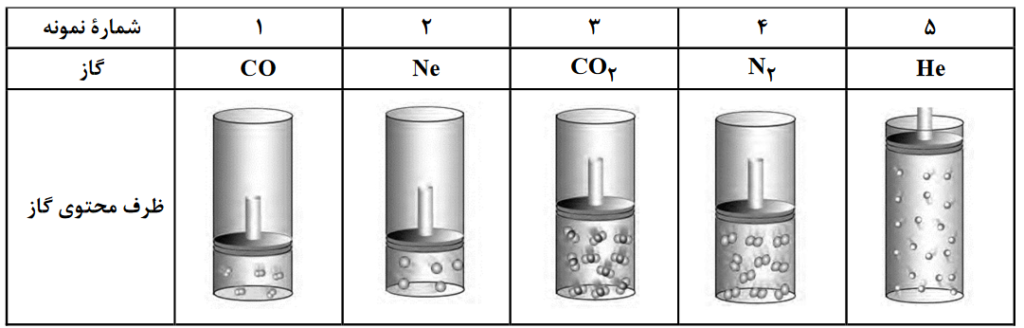
- شمار اتمهای نمونۀ 4، دو برابر شمار مولکولهای نمونۀ 1 است.
- حجم گاز نمونۀ 4، دو برابر حجم گاز نمونه 1 و برابر 22.4 لیتر است.
- مجموع جرم گاز در نمونههای 1 و 3، 2.9 برابر جرم گاز در نمونۀ 2 است.
- جرم گاز نمونۀ 5، 80 درصد جرم گاز نمونۀ 2 و حجم آن، 4 برابر حجم گاز نمونۀ 1 است.
پاسخ:
با توجه به قانون آووگادرو، در دما و فشار یکسان، حجم مولی گازها برابر است. با توجه به این موضوع به سراغ گزینهها میرویم:
گزینه 1: شمار اتمهای نمونۀ 4، دو برابر شمار مولکولهای نمونۀ 1 است:
نادرست است؛ زیرا نمونۀ 4، متناسب با 10 مولکول و 20 عدد اتم است، و نمونۀ 1، متناسب با 5 تا مولکول است؛ پس شمار اتمهای نمونۀ 4، چهار برابر شمار مولکولهای نمونۀ 1 است.
گزینه 2: حجم گاز نمونۀ 4، دو برابر حجم گاز نمونه 1 و برابر 22.4 لیتر است:
نادرست است: نمونۀ 4 دارای 10 ذره بوده که هر ذره؛ طبق صورت سوال، معادل 0.1 مول است، پس نمونۀ 4، برابر با 1 مول گاز نیتروژن است؛ به همین ترتیب دارای 5 ذره بوده که معادل 0.5 مول گاز CO هست، حال با توجه به برابر بودن دما و فشار، و دو برابر بودن تعداد مول نمونه 4 نسبت به نمونه 1، حجم گاز نمونۀ 4، دو برابر حجم گاز نمونۀ 1 خواهد بود، ولی فقط در شرایط STP حجم این 1 مول گاز برابر با 22.4 لیتر خواهد بود و اگر دما و فشار استاندارد نباشند، حجم 1 مول گاز عددی غیر از 22.4 لیتر میتواند باشد.
گزینۀ 3: مجموع جرم گاز در نمونههای 1 و 3، 2.9 برابر جرم گاز در نمونۀ 2 است:
نادرست است، زیرا برای به دست آوردن جرم هر نمونه، باید تعداد مول موجود را در جرم مولی آنها ضرب کنیم، نمونه 1، دارای 0.5 مول گاز CO بوده، پس با توجه به جرم مولی آن، جرم نمونۀ 1، برابر است با:
0.5×28=14gCO
نمونه 3، دارای 1 مول گاز CO2 بوده، پس با توجه به جرم مولی آن، جرم نمونۀ 3، برابر است با:
1×44=44gCO2
پس مجموع جرم نمونۀ 1 و 3 برابر است با:
14+44=58g
از طرفی نمونه 2، دارای 0.5 مول گاز Ne بوده، پس با توجه به جرم مولی آن، جرم نمونۀ 2، برابر است با:
0.5×20=10gNe
پس نسبت مجموع جرم گاز در نمونههای 1 و 3، با نمونۀ 2 برابر است با:
58÷10=5.8
گزینه 4: جرم گاز نمونۀ 5، 80 درصد جرم گاز نمونۀ 2 و حجم آن، 4 برابر حجم گاز نمونۀ 1 است:
درست است، نمونه 5، دارای 2 مول گاز He بوده، پس با توجه به جرم مولی آن، جرم نمونۀ 1، برابر است با:
2×4=8gHe
با توجه به گزینۀ قبلی، جرم نمونۀ 2 برابر با 10 گرم و جرم نمونۀ 1 نیز برابر با 14 گرم هست، پس جرم گاز نمونۀ 5، 80 درصد جرم گاز نمونۀ 2 میباشد و حجم گاز نمونۀ 5، (با توجه به اینکه 2 مول دارد) 4 برابر حجم گاز نمونۀ 1 است (زیرا نمونۀ 1 دارای 0.5 مول است)
بنابراین پاسخ گزینه 4 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مفهوم اتم و مولکول
- احاطه مبحث حجم مولی و جرم مولی
تحلیل سوال:
- تست دیگری از مبحث استوکیومتری که تمرکز بر روی قسمت حجم گازها بود
بخش زیبای تست:
- گزینه 2 به زیبایی تفاوت عددی حجم مولی گازها، در دما و فشار یکسان و شرایط STP را نشان داد.
بخش دوست نداشتنی تست:
- تعداد ذرات موجود در نمونهها برای شمارش، با توجه به وقت محدود کنکور، زیاد بودند.

