سوال 76 دفترچه (سوال 1 شیمی)تجربی، اردیبهشت1403
در یک ظرف دربسته، 0.5 مول گاز SO2Cl2 بطور کامل تجزیه میشود. اگر در همین طرف و پس از پایان واکنش، به ترتیب 0.8 و 0.4 مول گازهای CO و O2 وارد شده و 50 درصد آنها به فراورده شوند، چند درصد از مولهای گازی درون ظرف را SO2 تشکیل میدهد؟ (واکنشها برگشتناپذیر درنظر گرفته شوند، واکنش دیگری انجام نمیشود.)
SO2Cl2(g)→SO2(g)+Cl2(g)
2CO(g)+O2(g)→2CO2(g)
1) 12.5
2) 25
3) 50
4) 37.5
پاسخ:
در واکنش اول، با استفاده از استوکیومتری، از 0.5 مول SO2Cl2، مقدار مولهای SO2 و Cl2 را به دست میآوریم:
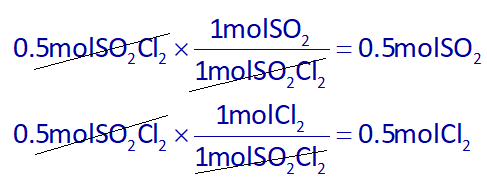
در واکنش دوم، %50 واکنش دهندهها مصرف شده و تبدیل به CO2 میشوند. پس مقدار مصرفی CO و O2 برابرند با:
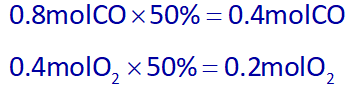
حال میتوان با استفاده از مقدار مصرفی CO یا مقدار مصرفی O2، از روش استوکیومتری، مقدار تولید شده CO2 را به دست آوریم:
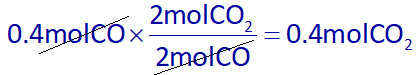
پس تعداد مول گازهای تولید شده در واکنشهای اول و دوم را به دست آوردیم، از طرفی، با توجه به اینکه در واکنش دوم، 50 درصد واکنش دهندهها مصرف میشوند، پس 50 درصد دیگر آنها در ظرف باقی میمانند، یعنی از 0.8 مول اولیۀ گاز CO، مقدار 0.4 مول آن مصرف شده پس 0.4 مول از آن باقی میماند. و از 0.4 مول اولیۀ گاز O2، مقدار 0.2 مول از آن مصرف شده پس 0.2 مول آن، باقی میماند، در نتیجه در انتهای واکنشها:
0.5molSO2 و 0.5molCl2 و 0.4molCO و 0.2molO2 و 0.4molCO2 خواهیم داشت، و از آنجایی که همگی گاز هستند تعداد مولهای گازی برابر خواهد بود با:
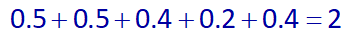
و در آخر درصد مول گاز SO2 نسبت به تمامی گازها برابر است با:
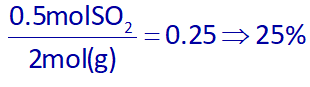
بنابراین پاسخ گزینه 2 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث استوکیومتری
تحلیل سوال:
- استوکیومتری بخش جداییناپذیر شیمی بوده که ردپای آن را در بیشتر سوالهای کنکور میبینیم.
بخش زیبای تست:
- در واکنش دوم، با داده شدن مقدار عددی هر دو واکنشدهنده، این سوال را برای برخی از داوطلبان ایجاد میکند که مقدار CO2 تولیدی، از استوکیومتری یکی از واکنشدهندهها به دست آورند یا از استوکومتری مجموع هر دو واکنشدهنده.
بخش دوست نداشتنی تست:
- سوال استانداری بود، فقط میشد برای زیباتر شدن تست، با توجه به گازی بودن همه مواد، از حجم آنها نیز استفاده کرد.


2 نظر
بسیار سپاسگزاریم از معلمان دلسوزی همچون شما
ممنون از شما