سوال 110 دفترچه(سوال 35 شیمی)تجربی،اردیبهشت1403
0.06 مول گاز NO₂Cl وارد ظرف 2 لیتری دربسته میشود. اگر در شرایط مناسب انجام واکنش، کاهش جرم واکنشدهنده تا رسیدن به تعادل گازی:
2NO₂Cl ⇌ Cl₂ + 2NO₂
برابر 3.26 گرم باشد، ثابت تعادل و شمار مولهای گازی درون ظرف در حالت تعادل، کدام است؟
(N=14 , O=16 , Cl=35.5 : g.mol⁻¹)
۱) 0.08 ، 0.04
۲) 0.04 ، 0.04
۳) 0.08 ، 0.08
۴) 0.04 ، 0.08
پاسخ:
با توجه به صورت سوال، 0.06 مول مقدار اولیۀ گاز NO₂Cl بوده و 3.26 گرم آن مصرف شده است، پس برای به دست آوردن مقدار مول باقیماندۀ NO₂Cl، ابتدا باید جرم مصرفی آن را به مول تبدیل کرده و سپس از مقدار اولیۀ آن کسر کنیم:
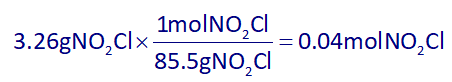
پس مقدار مول باقیماندۀ NO₂Cl برابر است با:
0.06-0.04=0.02molNO₂Cl
بنابراین خواهیم داشت:
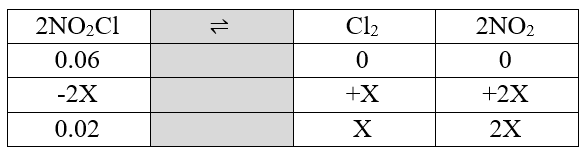
در نتیجه با توجه به ستون NO₂Cl، مقدار X به دست میآید:
0.06-2X=0.02
X=0.02
پس مقدار مول پایانی Cl₂ برابر است با X، که همان 0.02mol میباشد، و مقدار مول پایانی NO₂ برابر است با 2X، که 0.04mol میشود.
بدین صورت تعداد مولهای گازی، در حالت تعادل برابر است با:
0.02+0.02+0.04=0.08mol
و ثابت تعادل به توجه به 2 لیتری بودن ظرف، به صورت زیر خواهد بود:
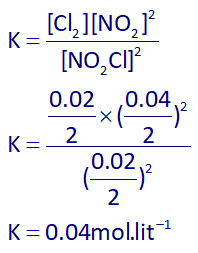
بنابراین پاسخ گزینۀ 4 هست.
پیش نیاز لازم برای پاسخ به این تست:
- احاطه بر مبحث واکنشهای تعادلی
- احاطه بر استوکیومتری
تحلیل سوال:
- این سری تستها که در اکثر کنکورها حضور دارند متاسفانه کتاب درسی به طور مستقیم به آنها نپرداخته است، ولی یادگیری آنها برای کنکور الزامی است.
بخش زیبای تست:
- استفاده از مقدار جرم مصرفی واکنش دهنده برای به دست آوردن باقیماندۀ آن، بخش زیبای این تست بود.
بخش دوست نداشتنی تست:
- ندارد. تست استانداردی بود.
برای دستیابی به نمره 20 امتحان نهایی و درصد بالای کنکور، به اندازۀ یک کلیک فاصله داری.

