سوال 105 دفترچه (سوال 30 شیمی)رشته تجربی، تیر1403
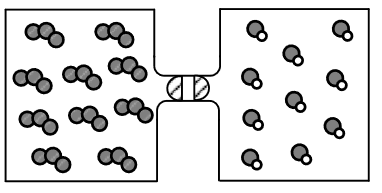
اگر گازهای O2 و NO در دو ظرف یک لیتری مطابق شکل و با بازشدن شیر با یکدیگر مخلوط شوند و واکنش تعادلی:
O3(g)+NO(g)⇌O2(g)+NO2(g) ، K=9 انجام گیرد، پس از برقراری تعادل، غلظت مولی گاز اکسیژن کدام است و در مجموع چند مول گاز در ظرف وجود دارد؟ (هر ذره، معادل 0.1 مول ماده است.)
1) 0.75 ، 2
2) 0.375 ، 2
3) 0.375 ، 1
4) 0.75 ، 1
پاسخ: از آنجایی که هر ذره، معادل 0.1 مول ماده است، پس 1 مول O3 و 1 مول NO در ابتدای کار داریم و هر کدام در یک ظرف 1 لیتری هستند، در نتیجه با باز شدن شیر، و شروع واکنش، مجموعا 2 لیتر حجم خواهیم داشت، پس به سراغ حل استوکیومتری واکنش تعادلی برویم:
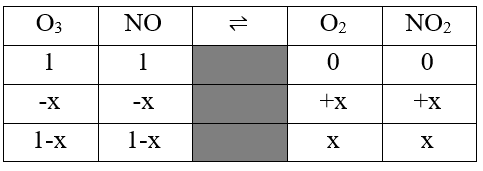
با توجه به واکنش ثابت تعادل برابر است با:
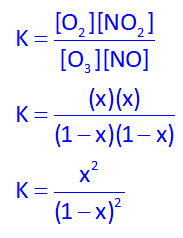
از طرفی، سوال مقدار K=9 داده است، پس:
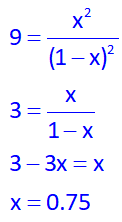
حال با به دست آمدن x=0.75، پس تعداد مول تعادلی:
- O3=0.25
- NO=0.25
- O2=0.75
- NO2=0.75
خواهد بود، و از آنجایی که حجم کلا 2 لیتر میباشد، پس غلظتِ مولار تعادلی گاز اکسیژن (که نسبت تعداد مول گاز اکسیژن تقسیم بر حجم ظرف است) برابر با:
0.75÷2=0.375
خواهد بود.
و مجموع تعداد مول مواد در ظرف برابر با:
0.25+0.25+0.75+0.75=2
خواهد بود.
بنابراین جواب گزینۀ 2 خواهد بود.
پیش نیازهای لازم برای پاسخ به این تست:
- احاطه بر استوکیومتری تعادلی
- آشنایی با غلظت مولار
تحلیل سوال:
- سری سوالهای استوکیومتری در واکنشهای تعادلی به طور معمول در کنکور حضور دارند که این تست از لحاظ مفهومی، در حد متوسط این دسته سوالها بود.
بخش زیبای تست:
- تغییر غیرمحسوس حجم، از 1 لیتر به 2 لیتر از زیباییهای این تست بود.
بخش دوست نداشتنی تست:
- ندارد؛ تست استانداردی بود.

