سوال 100 دفترچه (سوال 25 شیمی)رشته تجربی، تیر1403
اگر از الکترونهای تولید شده در سلول سوختی هیدروژن، برای تهیه فلز منیزیم از آب دریا استفاده شود، با مصرف چند کیلوگرم گاز هیدروژن در سلول سوختی با بازدهی ۶۰ درصد، میتوان ۱۸ کیلوگرم منیزیم مذاب تهیه کرد؟
(H=1,Mg=24:g.mol−1)
MgCl2(l)→Mg(l)+Cl2(g)
۱) 25
۲) 12.5
۳) 2.5
۴) 1.25
پاسخ:
با توجه به سلول سوختی نیم واکنش آندی مربوط به هیدروژن (SHE) برابر است با:
H2(g)→2H+(aq)+2e : نیم واکنش آندی
از طرفی در واکنش داده شده در صورت سوال، یون منیزیم کاهش مییابد (الکترون میگیرد) و الکترون خود را از هیدروژن سلول سوختی میگیرد، پس نیم واکنش کاتدی خواهد شد:
Mg2+(aq)+2e→Mg(s) : نیم واکنش کاتدی
در نتیجه از جمع نیم واکنش آندی و نیم واکنش کاتدی، به واکنش کلی میرسیم:
H2(g)+Mg2+(aq)→2H+(aq)+Mg(s)
حال با داشتن واکنش کلی و استفاده از استوکیومتری، به سراغ حل تست میرویم:
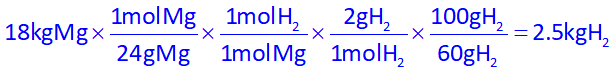
توجه داشته باشیم در استوکیومتری بالا، چون جرم منیزیم بر حسب کیلوگرم داده شده و گاز هیدروژن هم بر حسب کیلوگرم خواسته شده، دیگر کیلوگرم را به گرم تبدیل نکردیم، همچنین در کسر آخر، بازده درصدی را لحاظ کردیم.
بنابراین جواب گزینۀ 3 خواهد بود.
پیش نیازهای لازم برای پاسخ به این تست:
- احاطه بر مبحث برقکافت و سلولهای الکترولیتی
- آشنایی با سلول سوختی هیدروژن-اکسیژن
- احاطه بر استوکیومتری
تحلیل سوال:
- از ادغام سلول سوختی و برقکافت به یک تست با کیفیت رسیدیم که اهمیت یادگیری نوشتن نیم واکنشها را نشان میداد.
بخش زیبای تست:
- اینکه از کاربرد الکترونهای بخش آندی سلول سوختی در سلولی دیگر استفاده شده مشخص است با یک طراح خلاق روبهرو هستیم که از نسل جدید سوال کنکور در این مبحث رونمایی میکند.
بخش دوست نداشتنی تست:
- ندارد؛ تبریک به طراح خلاق این تست.

