با مراجعه به جدول پتانسیل کاهشی استاندارد متوجه میشویم که ˚E نیم سلول روی (Zn) از نیم سلول مس (Cu) کمتر است، پس تمایل Zn به اکسایش (از دست دادن الکترون) بیشتر از Cu هست، در نتیجه Zn دهنده الکترون (اکسایش) و Cu گیرنده الکترون (کاهش) میباشد؛ در نتیجه نیم واکنشهای آندی و کاتدی به صورت زیر خواهد بود:
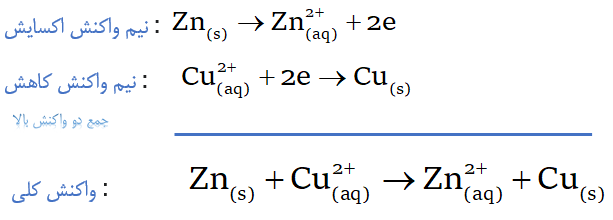
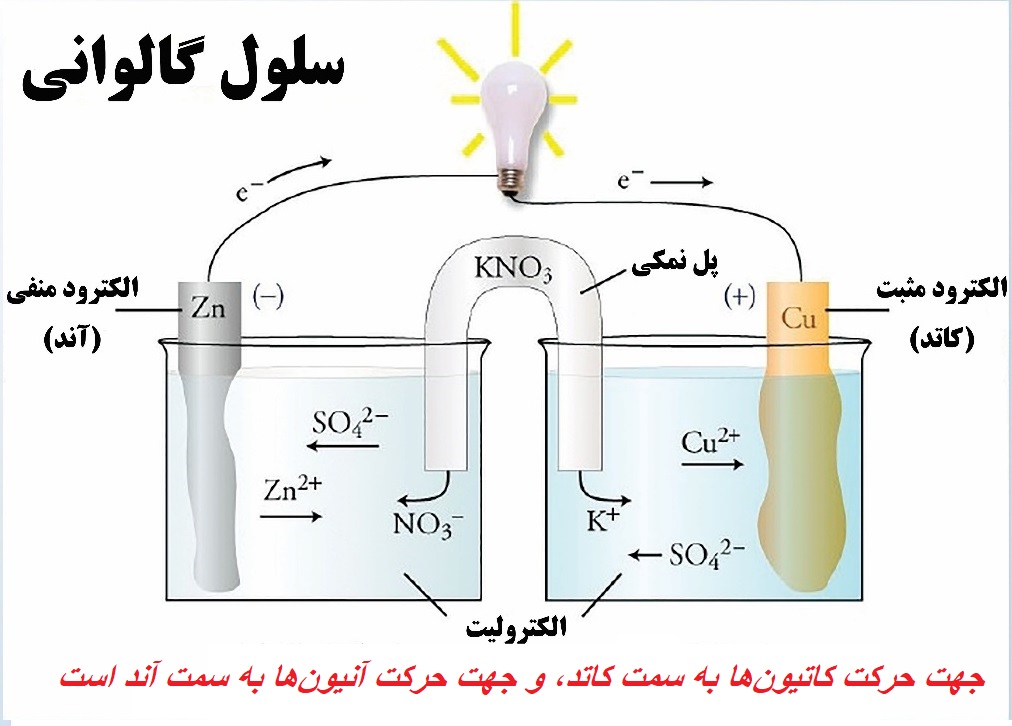
به همین دلیل است که با اتصال دو نیم سلول روی-مس توسط سیم به همدیگر، الکترون از نیم سلول روی (آند) به نیم سلول مس (کاتد) جریان پیدا میکند.
پل نمکی یا دیوار متخلخل، گذرنده دارای یونی است که از امتزاج محلولهای نیم سلولها جلوگیری کرده و فقط یونها از آن عبور میکنند.
حال برای اینکه محلولهای الکترولیت خنثی بمانند ( تعداد یونهای مثبت و منفی برابر بماند) کاتیونها (یونهای مثبت) از پل نمکی به سمت کاتد رفته و آنیونها (یونهای منفی) از پل نمکی به سمت آند میروند.
در سلول الکتروشیمی، به سیم، مدار بیرونی و به پل نمکی یا دیوار متخلخل، مدار درونی گوییم.
در سلول گالوانی آند قطب منفی (-) و کاتد قطب مثبت (+) محسوب میشود، پس در سلول روی-مس، روی (Zn) قطب منفی و مس (Cu) قطب مثبت به شما میروند.
سوال: با اتصال دو نیم سلول منیزیم-طلا توسط سیم و پل نمکی، میتونی از واکنش زیر مشخص کنی، قطب مثبت و منفی کدوم هستن؟
3Mg(s)+2Au3+(aq)→3Mg2+(aq)+2Au(s)
یک نظر
منیزیم:اکسایش ،آند،(قطب منفی)
طلا:کاهش،کاتد،(قطب مثبت)