به طور کلی سلولهای الکتروشیمی، از اتصال دو نیم سلول به همدیگر (با یک سیم) یک سلول الکتروشیمی تشکیل میشود.
از طرفی از پستهای قبل میدانیم که نیم سلول یعنی قرار دادن یک جسم رسانا (مانند فلز) در یک محلول الکترولیت، مطابق شکل زیر که با قرار دادن یک تیغه از جنس روی (Zn) در یک محلول الکترولیت (حاوی یون)، یک نیم سلول تشکیل شده است:
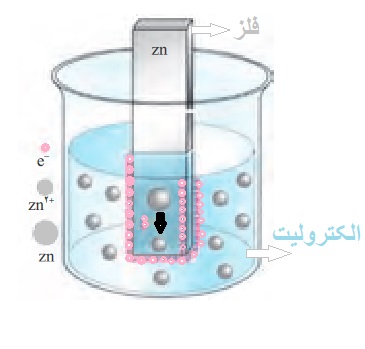
نیم واکنش حاصل از نیم سلول بالا به صورت زیر خواهد بود:
Zn2+(aq)+2e⇌Zn(s)
همان طور که در نیم واکنش بالا میبینیم با توجه به برگشت پذیر بودن آن (⇌) در جهت رفت، یون روی (+Zn2) با گرفتن الکترون، تبدیل به فلز روی شده، و متقابلا فلز روی در جهت برگشت، با از دست دادن الکترون تبدیل به یون روی میشود.
در ادامه اگر یک نیم سلول دیگر، مانند SHE یا نیم سلول استاندارد هیدروژن، به نیم سلول روی، توسط یک سیم متصل کنیم، سلول الکتروشیمی روی-هیدروژن را تشکیل دادهایم:
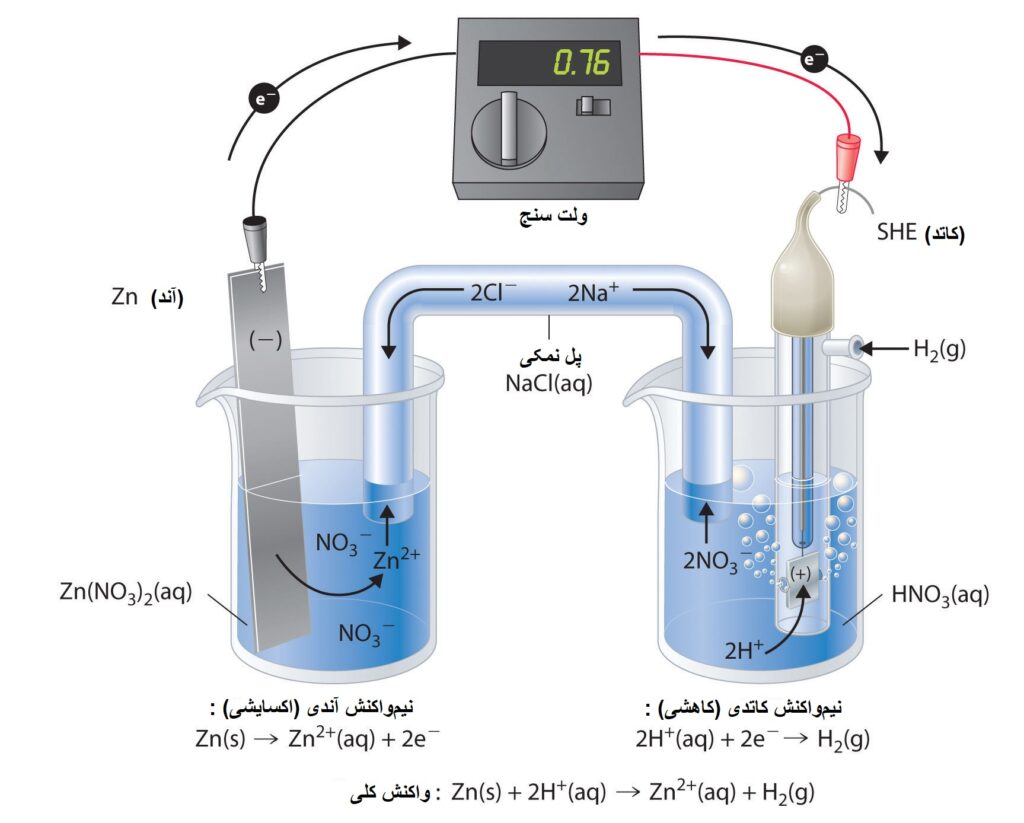
حال که با مفهوم سلول الکتروشیمی آشنا شدیم، بریم سراغ تفاوت سلول گالوانی و سلول الکترولیتی:
همان طور که در شکل بالا میبینیم، سلول گالوانی دارای پل نمکی یا دیوار متخلخل و دو محلول الکترولیت متفاوت و جدا از همدیگر هستند، ولی سلولهای الکترولیتی در مدار بیرونی (سیم) آنها باتری وجود دارد و خبری از دیوار متخلخل یا پل نمکی نیست و فقط یک محلول الکترولیت وجود دارند.
به عنوان مثال، سلول روی-هیدروژن که در بالا بررسی کردیم، یک سلول گالوانی است، چون باتری به سیم متصل نیست و پل نمکی میبینیم با دو محلول الکترولیت متفاوت.
در پست بعدی با سلول گالوانی روی-مس آشنا میشویم تا کم کم تفاوت دو سلول گالوانی و الکترولیتی را کاملا متوجه شویم.
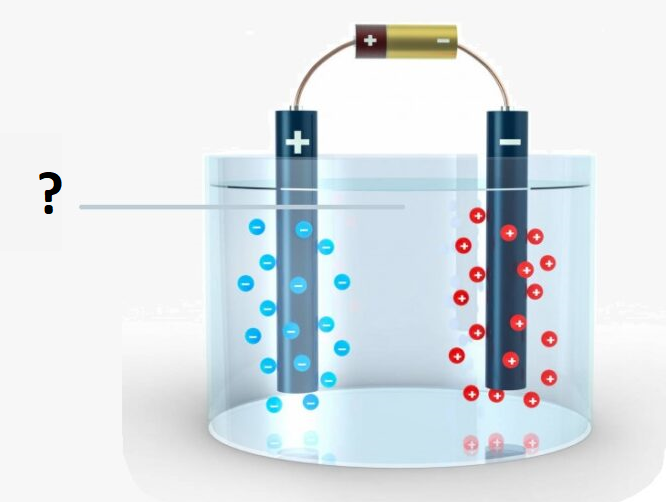
یک نظر
الکترولیتی زیرا به باتری متصل است و دیواره ی متخلخل وجود ندارد