همان طور که در پست مفهوم سینتیک متوجه شدیم سرعت یک ماده در واکنش برابر است با نسبت تغییرات مول یا غلظت یک ماده به زمان:

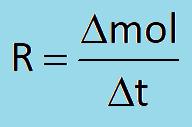
همچنین متوجه شدیم سرعت هر ماده در یک واکنش با ضریب استوکیومتری آن ماده رابطه مستقیم دارد، یعنی هر چه ضریب استوکیومتری یک ماده بیشتر باشد، سرعت آن نیز بیشتر خواهد بود، مثلا در واکنش زیر بیشترین سرعت مربوط به گاز هیدروژن (H2) میباشد، چون بیشترین ضریب استوکیومتری را دارد:
N2(g)+3H2(g)→2NH3(g)
حال در واکنش بالا با تقسیم سرعت هر ماده بر ضریب استوکیومتری آن، سرعت واکنش را به دست میآوریم، مطابق زیر:
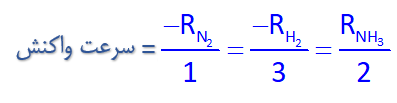
علت قرار گرفتن منفی قبل از سرعت H2 و N2 این است که آنها واکنش دهندهاند و در حال مصرف شدن هستند.
موردی که جالب است اینجاست که با توجه به رابطه بالا میتوان با داشتن سرعت یکی از مواد، سرعت هر مادۀ دیگری در واکنش را به دست آورد، مثلا اگر سرعت مصرف گاز هیدروژن (H2) در یک زمان معین، برابر با 6mol.L-1.s-1 باشد، سرعت تولید آمونیاک (NH3) در همان زمان برابر است با:
