منظور از گروه اصلی که در مرحله 2 آورده شده، عناصر دستۀ s و p هست، که شامل 8 گروه (2 گروه s و 6 گروه p) میشوند، به عنوان مثال کربن (C) در گروه 14 قرار دارد، ولی گروه اصلی کربن، 4 میشود، به عبارتی شماره گروه اصلی عناصر دستۀ p، به جای گروههای 13 تا 18، شامل گروههای 3 تا 8 میشوند.
عدد به دست آمده از مرحلۀ سوم، تعداد پیوندهای بین اتمها را نشان میدهد.
بر اساس ساختار لویس اطراف هر اتمی (به جز هیدروژن) باید 8 تا الکترون وجود داشته باشد که هر پیوند نشان دهندۀ 2 الکترون است و الکترونهای ناپیوندی را با آرایش نقطهای اطراف اتمها نشان میدهیم که مجموع الکترونهای پیوندی و ناپیوندی همان طور که گفته شد باید 8 تا شوند.
برای درک بهتر توضیحات داده شده برویم سراغ مثال:
مثال1: ساختار لویس CO2
C در گروه 14 یا 4 اصلی قرار دارد و O در گروه 16 یا 6 اصلی قرار گرفته است، همچنین همان طور که میبینیم مولکول CO2 دارای 3 اتم هست. پس 3 مرحله را انجام میدهیم:
در مرحله اول که 3 تا اتم داریم، پس میشود:
3×8=24
در مرحله دوم میگوییم که یک اتم کربن داریم که در گروه 4 اصلی قرار گرفته و دو تا اتم اکسیژن داریم که در گروه 6 اصلی است، پس:
4(1)+6(2)=16
در مرحله سوم هم تفاضل مرحله اول و دوم تقسیم به دو تعداد پیوندهای بین اتمها را به ما نشان میدهد:
24-16=8, 8÷2=4
حال برای رسم ساختار لویس، کربن را در وسط قرار داده و 2 اتم اکسیژن را در اطراف میگذاریم،
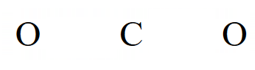
اکنون 4 پیوند به دست آمده از مراحل را رسم میکنیم:
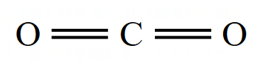
در آخر هشتایی بودن اتمها را بررسی میکنیم، کربن که در اطرافش 4تا پیوند وجود دارد پس 8تا الکترون را دارد ( زیرا هر پیوند 2تا الکترون محسوب میشود) ولی در کنار هر اکسیژن دو تا پیوند میبینیم که میشود 4تا الکترون، پس برای اینکه قاعده هشتایی را اکسیژنها رعایت کنند، اطراف هر اکسیژن 4 تا الکترون ناپیوندی اضافه میکنیم تا مجموعا در اطراف هر اکسیژن نیز 8 تا الکترون داشته باشیم (4 تا الکترون پیوندی و 4 تا الکترون ناپیوندی)، پس ساختار لویس CO2 به صورت زیر خواهد بود:
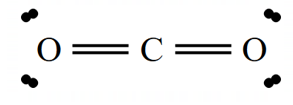
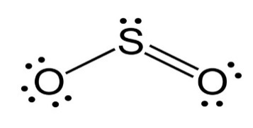
بریم سراغ رسم ساختار لویس SO2
مرحله اول: تعداد اتمها ضربدر ۸ ، چون یک عدد گوگرد (S) و دو تا اکسیژن (O) داریم پس 3 تا اتم داریم که میشود:
3×8=24
مرحله دوم: شماره گروه اصلی هر اتم ضربدر تعدادش؛ که هم گوگرد و هم اکسیژن در گروه ۱۶ یا ۶ اصلی قرار دارند پس مرحله دوم هم میشود:
3×6=18
مرحله سوم هم میشود تفاضل مرحلۀ اول و دوم تقسیم بر 2:
24-18=6, 6÷2=3
پس سه تا پیوند داریم و اتم مرکزی هم میشود S که دو تا O در کنارش قرار دارند:
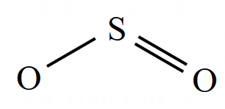
در آخر ساختار را باید هشتایی کنیم، S چون سه تا پیوند داره پس ۶ تا الکترون اطرافش هست پس دو تا الکترون ناپیوندی به آن اضافه میکنیم تا اطرافش ۸تا الکترون داشته باشد، اکسیژنی که پیوند دوگانه به S زده، پس ۴ تا الکترون داره که نیاز به چهار تا الکترون دیگر یا دو جفت الکترون ناپیوندی دارد تا بشود ۸تا الکترون. اکسیژنی هم که پیوند یگانه زده پس دو تا الکترون دارد که آن هم برای اینکه الکترونهایش ۸ تا شود نیاز به ۶ تا الکترون دیگر یا سه تا جفت الکترون ناپیوندی دیگه دارد، و ساختار لویس آن به صورت زیر خواهد شد: