ببینیم فرمول بالا از کجا میاد:
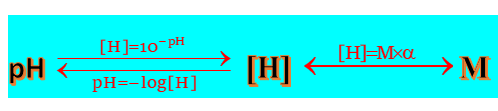
در پست قبلی متوجه شدیم که غلظت اسید (M) برابر است با نسبت تعداد مول های حل شونده به حجم محلول:

و درجه یونش (α) معادل نسبت تعداد مول های یونیده شده (تفکیک شده) به تعداد مول های حل شده است:

حال حاصلضرب غلظت اسید و درجه یونش اسید برابر است با غلظت یون هیدرونیوم آن اسید:

و با توجه به اینکه pH=-log[H+] میتوان از غلظت یون هیدرونیوم اسید به pH آن رسید، متقابلا میتوان از pH اسید به غلظت یون هیدرونیوم رسید، طبق رابطۀ زیر:
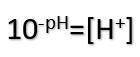
منظور از اسیدهای تک پروتوندار، اسیدهایی هستند که فقط یک بار یونش پیدا میکنند، یا به عبارتی به ازای 1 مول از آن اسید، فقط 1 مول یون هیدرونیوم در آب آزاد میشود، مانند اسید HCl:
HCl(aq)→H+(aq)+Cl–(aq)
همان طور که در واکنش یونش هیدروکلریک اسید میبینیم، به ازای 1 مول از آن، 1 مول یون هیدرونیوم آزاد میشود. البته تمامی اسیدها تک پروتوندار نیستند، مثلا سولفوریک اسید (H2SO4) اسید تک پروتوندار محسوب نمیشود، زیرا به ازای یونش 1 مول از این اسید، 2 مول یون هیدرونیوم آزاد میشود:
H2SO4(aq)→2H+(aq)+SO4-2(aq)
اکنون که رابطۀ بالا و دلیل آن را میدانیم زمان حل یک مثال است:
مثال: اگر pH اسید HA برابر با 2 باشد و درصد یونش آن 3% باشد، غلظت یون هیدرونیوم این اسید چند مول بر لیتر است؟
اول از همه به این موضوع دقت کنیم که سوال به جای درجه یونش از درصد یونش استفاده کرده، و چون در فرمول گفته شده ما نیاز به درجۀ یونش داریم ابتدا درصد یونش را به 100 تسیم میکنیم تا به درجۀ یونش تبدیل شود:
3/100=3×10-2
حال از pH اسید به غلظت یون هیدرونیوم میرسیم:
10-pH=[H+] , pH=2 :
10-2=[H+]
و در آخر از غلظت یون هیدرونیوم به غلظت اسید میرسیم:
[H+]=M×α
10-2=M×3×10-2
M=3mol.lit-1