خود را بیازمایید صفحه19 شیمی دوازدهم
1- نیتریک اسید، یک اسید قوی است. در محلول 0.2 مولار این اسید، غلظت یونهای هیدرونیوم و نیترات را با دلیل پیشبینی کنید.
پاسخ:
نیتریک اسید (HNO₃) یک اسید قوی است و در آب به طور کامل یونیده میشود:
HNO₃(aq)→H⁺(aq)+NO₃⁻(aq)
غلظت اولیه اسید: 0.2 مول بر لیتر میباشد که با توجه به قوی بودن اسید، تمامی آن یونیده شده و طبق واکنش بالا تبدیل به فراوردهها میشود، پس خواهیم داشت:
[H⁺]=0.2 M , [NO₃⁻]=0.2 M
2- اگر در محلول 0.1 مولار استیک اسید (CH₃COOH)، غلظت یون هیدرونیوم برابر با 3-10×1.35 مول بر لیتر باشد:
آ) معادله یونش استیک اسید را بنویسید.
پاسخ:
CH₃COOH(aq)⇌H⁺(aq)+CH₃COO⁻(aq)
ب) درصد یونش آن را حساب کنید.
پاسخ:
غلظت استیک اسید را برابر با M و غلظت یون هیدرونیوم را برابر با [⁺H] قرار میدهیم، پس خواهیم داشت:
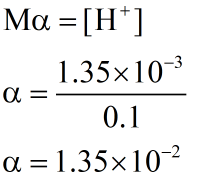
برای درک بهتر خودآزمایی بالا، این پست را مطالعه فرمایید یا در این آزمون رایگان شرکت کنید.

