خودرابیازمایید صفحه28 شیمی دوازدهم
1- در دما و غلظت یکسان، pH کدام محلول زیر کمتر است؟ چرا؟
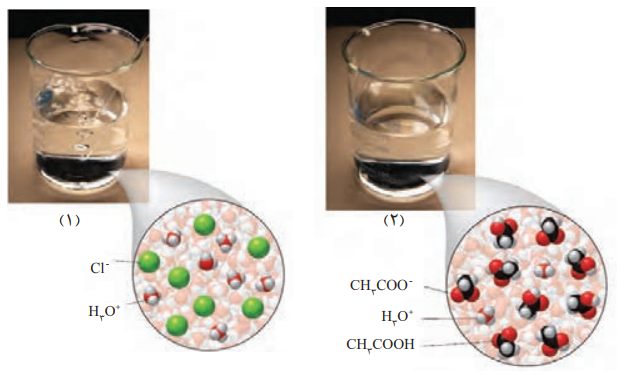
پاسخ:
محلول 1 (هیدروکلریک اسید)؛ زیرا یون هیدرونیوم (+H3O) بیشتری در آب آزاد میکند، و هرچه یک اسید یون هیدرونیوم (+H3O) بیشتری در آب آزاد کند، قویتر است، و pH کمتری دارد.
2- جدول زیر را کامل کنید.
پاسخ:
| نام محلول | غلظت محلول | [+H] | [−OH] | pH | درصد یونش |
|---|---|---|---|---|---|
| هیدروکلریک اسید | 0.004 | 0.004 | 10-12×2.5 | 2.4 | 100 |
| هیدروفلوئوریک اسید | 0.004 | 10-4 | 10-10 | 4 | 2.5 |
| نیتریک اسید | 10-4×2 | 10-4×2 | 10-11×5 | 3.7 | 100 |
| نمونهای از آب یک دریاچه | – | 10-9×3 | 10-4×3.3 | 8.52 | – |
توضیح:
با توجه به رابطههای زیر:
[H+][OH−]=10−14
[H+]=Mα
pH= -log[H+]
[H+]=10-pH
به سراغ هر سطر میرویم:
سطر اول: هیدروکلریک اسید:
M= 0.004= 4×10-3
از آنجایی که HCl یک اسید قوی هست پس درجه یونش آن برابر 1 بوده یا درصد یونش آن برابر 100% میباشد، پس خواهیم داشت:
[H+]=Mα
[H+]=4×10-3 ×1
و [−OH] برابر است با:
4×10-3[OH−]=10−14
[OH−]=2.5×10-12
و pH آن برابر خواهد بود با:
pH= -log[H+]
pH= -log4×10-3
pH= 3-log4= 2.4
سطر دوم: هیدروفلوئوریک اسید:
M= 0.004= 4×10-3
از آنجایی که درصد یونش برابر با 2.5 هست پس درجۀ یونش برابر با 2-10×2.5 خواهد بود، پس داریم:
[H+]=Mα
[H+]=4×10-3 ×2.5×10-2
[H+]= 10-4
و [−OH] برابر است با:
10-4[OH−]=10−14
[OH−]=10-10
و pH آن برابر خواهد بود با:
pH= -log[H+]
pH= -log10-4
pH= 4
سطر سوم: نیتریک اسید:
pH= 3.7
از آنجایی که درصد یونش برابر با 2.5 هست پس درجۀ یونش برابر با 0.025 خواهد بود، پس داریم:
[H+]=10-pH
[H+]=10-3.7
[H+]= 10-(4-0.3)
[H+]= 2×10-4
و [−OH] برابر است با:
2×10-4[OH−]=10−14
[OH−]=5×10-11
حال با توجه به اینکه نیتریک اسید یک اسید قوی هست و درجه یونش آن برابر 1 بوده یا درصد یونش آن برابر 100% میباشد، پس برای غلظت این اسید خواهیم داشت:
[H+]=Mα
2×10-4=M×1
M=2×10-4
سطر چهارم: آب دریاچه:
pH= 8.52
از آنجایی که درصد یونش برابر با 2.5 هست پس درجۀ یونش برابر با 0.025 خواهد بود، پس داریم:
[H+]=10-pH
[H+]=10-8.52
[H+]= 10-(9-0.48)
[H+]= 3×10-9
و [−OH] برابر است با:
3×10-9[OH−]=10−14
[OH−]=3.3×10-4
برای درک بهتر خودآزمایی بالا، این پست را مطالعه فرمایید یا در این آزمون رایگان شرکت کنید.

