در حد شیمی 3 جامدات کوالانسی عبارتند از: الماس، گرافیت، سیلیس، سیلیسم کاربید.
برای درک بهتر بیاییم با ساختار آنها آشنا شویم، ابتدا از الماس شروع میکنیم:
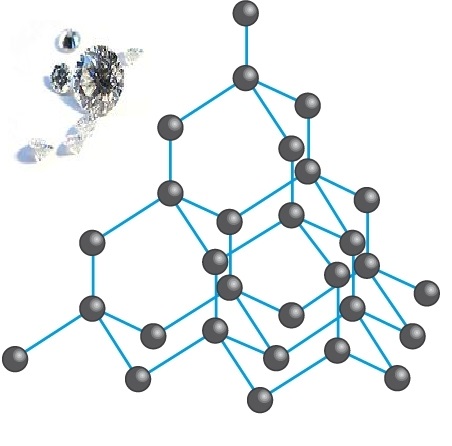
الماس فقط از اتم کربن ساخته شده است، مطابق شکل بالا، که ساختار الماس را نشان میدهد، هر اتم کربن توسط پیوند کوالانسی به 4 کربن دیگر متصل شده است، از آنجایی که در ساختار الماس الکترون آزادی وجود ندارد پس رسانای جریان برق نیست؛ ولی مقاومت گرمایی بسیار بالای دارد و بسیار ماده سختی است.
حال اگر هر کربن به سه کربن دیگر با پیوند کوالانسی متصل شود، به جای الماس، گرافیت خواهیم داشت، شکل زیر:
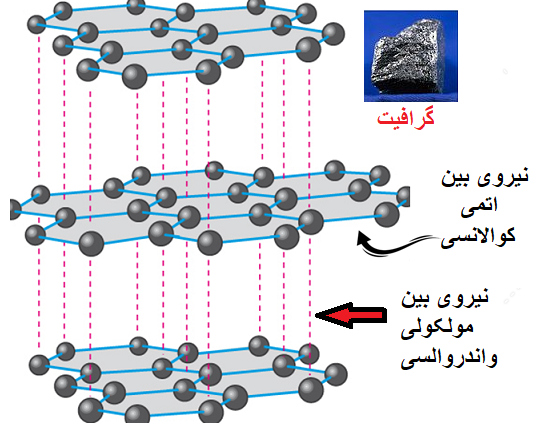
گرافیت با ساختار شش ضلعی خود حالت لایهای مانندی دارد که قدرت کشش هر کدام از این لایهها ۱۰۰ برابر فولاد هست، اما دلیل لایه لایه شدن گرافیت (مانند مغز مداد) این است که هر لایه توسط نیروهای بین مولکولی واندروالس به هم متصل میشن، و نیروهای بین مولکولی به هیچ عنوان مثل کوالانسی قوی نیستند و راحت از هم جدا میشوند. (در پستهای بعدی، نیروهای بین مولکولی را خواهیم آموخت) ولی همان طور که گفته شد هر لایه استحکام و کشش فوقالعادهای دارد، به همین خاطر هست دانشمندان به هر لایه از گرافیت به علت خاص بودن آن، اصطلاحا گرافن میگویند. شکل زیر:
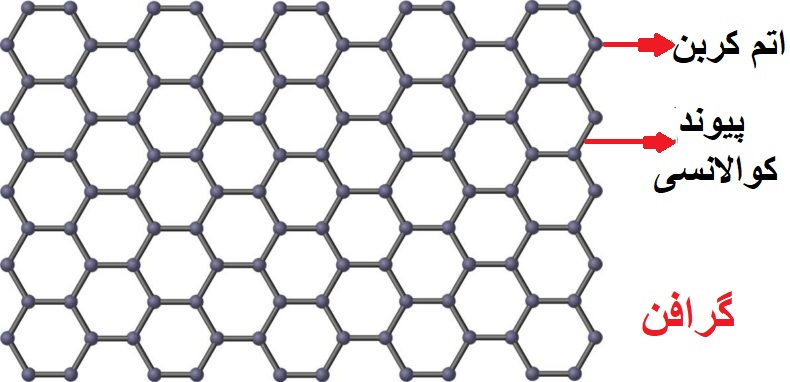
مطابق شکل بالا، گرافن مادهای تقریبا دو بعدی (به ضخامت یک اتم) با ساختار شش ضلعی که هر کربن با پیوند کوالانسی به ۳ کربن دیگر متصل است و از آنجایی که کربن توانایی ۴ الکترون برای پیوند زدن دارد، الکترون چهارم کربنهای آن آزاد بوده، پس گرافن دارای رسانای الکتریکی میباشد، به همین دلیل گرافیت رسانای جریان برق است.

یک نظر
خیر،زیرا در ساختار آن الکترون ها محکم به اتم ها متصل اند و قادر به عبور جریان الکتریکی نیستند