
ثابت یونش را با K نشان میدهیم که:
ثابت یونش اسیدها را با Ka نشان داده و ثابت یونش بازها را با Kb نشان میدهیم.
ثابت یونش فقط تابع دما است، یعنی ثابت یونش، با هیچ فاکتوری غیر از دما تغییر نمیکند، مثلا با تغییرات غلظت مواد و یا فشار سامانه نمیتوان ثابت یونش یک واکنش را تغییر داد.
با توجه به فرمول بالا، هر چقدر که میزان غلظت فرآوردهها به میزان غلظت واکنش دهندهها بیشتر باشد مقدار ثابت یونش یا K نیز بیشتر خواهد بود.
از آنجایی که قدرت اسید با غلظت یون هیدرونیوم رابطۀ مستقیم دارد، پس هرچه یک اسید قویتر باشد، بیشتر یونش پیدا کرده و یون هیدرونیوم بیشتری آزاد میکند، و با توجه به اینکه یون هیدرونیوم در فراورده وجود دارد، ثابت یونش نیز (طبق فرمول آن) با قدرت اسیدی رابطۀ مستقیم دارد، طبق جدول زیر:
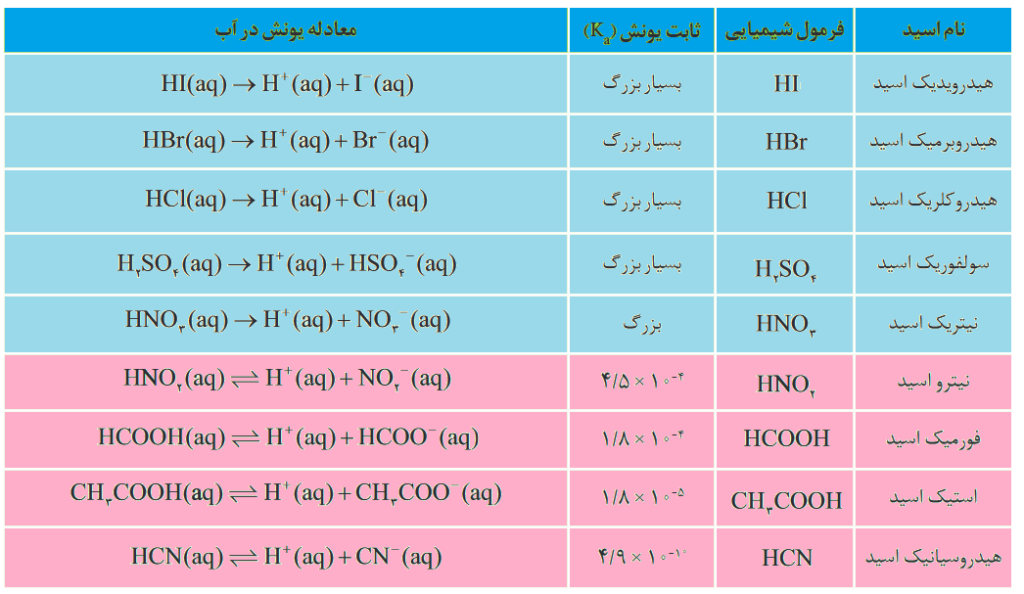
مثلا هیدروکلریک اسید (HCl) با توجه به اینکه اسید قدرتمندی است پس دارای غلظت یون هیدرونیوم بسیار زیاد و K بسیار بزرگی خواهد بود:

همان طور که در رابطه بالا میبینیم واکنش یونش اسیدهای قوی، یک طرفه (→) و برگشت ناپذیر است.
به همین ترتیب هیدروفلوئوریک اسید (HF) با توجه به اینکه اسید ضعیفی است پس دارای غلظت یون هیدرونیوم بسیار کم و K بسیار کوچکی خواهد بود:

همان طور که در رابطه بالا میبینیم واکنش یونش اسیدهای ضعیف، دوطرفه (⇌) و برگشت پذیر است.