مثلا، در واکنش فرضی و تعادلی زیر:
mA(g)+nB(g)⇌xC(g)+yD(g)
ثابت تعادل برابر خواهد بود با:
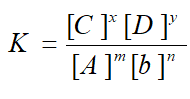
ثابت تعادل را با (K) نمایش میدهیم.
غلظت مورد استفاده در ثابت تعادل مولار (mol/lit) است که میدانیم برابر است با تعداد مول حل شونده به حجم محلول:
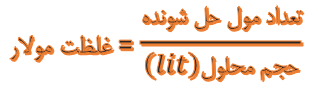
در فصل اول، ثابت تعادل را با نام ثابت یونش شناختیم و برای یونش اسیدها و بازها کاربرد داشت.
از مهمترین کاربردهای ثابت تعادل این است که تمایل یک واکنش تعادلی به حرکت در جهت رفت یا برگشت را مشخص میکند:
مثلا واکنشی که دارای ثابت تعادل زیادی است، پس نشان دهنده تمایل یک واکنش به حضور در سمت فراوردهها است (با توجه به فرمول ثابت تعادل که غلظت فراوردهها در صورت کسر قرار دارد)
متقابلا واکنشی که دارای ثابت تعادل کمی است، پس نشان دهنده تمایل یک واکنش به حضور در سمت واکنش دهندهها است (با توجه به فرمول ثابت تعادل که غلظت واکنش دهندهها در مخرج کسر قرار دارد)
در رابطه با ثابت تعادل (K) موردی که نباید فراموش کنیم این است که:
ثابت تعادل فقط تابع دما است، یعنی فقط با تغییرات دما، تغییر میکند و نمیتوان با تغییرات غلظت یا فشار و حجم، نمیتوان ثابت تعادل یک واکنش را تغییر داد.
مورد بالا را با استفاده از قانون لوشاتلیه در پستهای بعدی اثبات خواهیم کرد.
یک نظر
0.052