N2(g)+3H2(g)⇌2NH3(g) ∆H<0
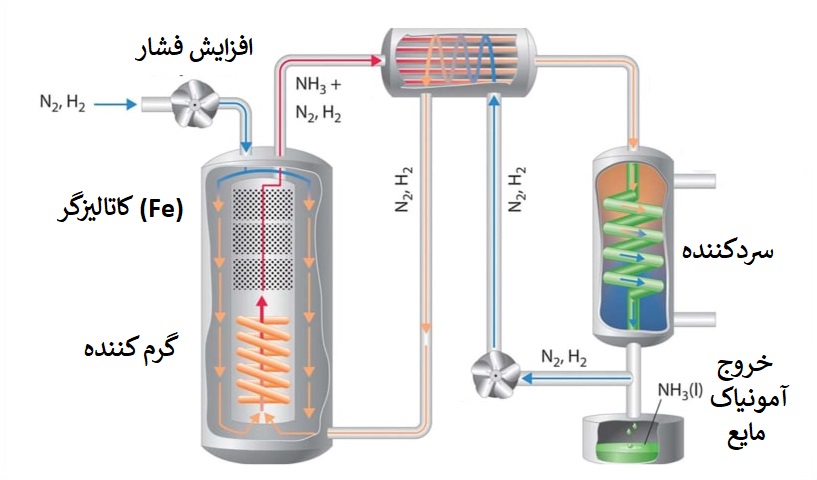
در شرایط استاندارد (T=25°C , P=1atm) فرایند تولید گاز آمونیاک از گازهای نیتروژن و هیدروژن بسیار ناچیز و کند است، پس دارای ثابت تعادل بسیار کمی است؛ حال میخواهیم با استفاده از اصل لوشاتلیه، تولید آمونیاک به روش هابر را بررسی کنیم:
با توجه به اینکه تعداد مولهای گازی در سمت واکنش دهنده بیشتر از تعداد مولهای گازی در سمت فراورده است (4 مول گازی در سمت واکنش دهندهها و 2 مول گازی در سمت فراورده)، پس فشار در سمت واکنش دهنده بیشتر از فراورده است (چون در پست قبل متوجه شدیم هر سمتی که تعداد مول گازی بیشتر باشد، آنجا فشار نیز بیشتر است)؛ در نتیجه با افزایش فشار، طبق اصل لوشاتلیه، واکنش به سمتی میرود که فشار کمتر است (یعنی سمت فراورده)؛ پس اول از همه برای تولید آمونیاک بیشتر، فشار را زیاد میکنیم.
در ادامه سراغ دما میرویم: با توجه به گرماده بودن واکنش (H<0∆) با کاهش دما واکنش به سمت فراورده پیشرفت میکند، زیرا میدانیم در واکنشهای گرماده، با کاهش دما واکنش به سمتی میرود که Q وجود دارد (در واکنشهای گرماده، Q در سمت فراوردهها وجود دارد)؛ پس دما را هم پایین میآوریم.
منتها مشکلی که با کاهش دما به وجود میآید این است که سرعت انجام واکنش کم میشود (سرعت با دما رابطه مستقیم دارد)؛ پس برای بالا رفتن سرعت (کم شدن انرژی فعال سازی) نیاز به کاتالیزگر مناسب داریم، که طی تحقیقات هابر (دانشمندی که بازده تولید آمونیاک را بالا برد) آهن، کاتالیزور مناسب برای این واکنش انتخاب شد.
پس نتیجه کار تا اینجا به صورت واکنش زیر خواهد شد:
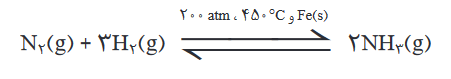
در آخر اگر بتوانیم غلظت آمونیاک را کاهش دهیم، طبق اصل لوشاتلیه واکنش برای جبران غلظت کم شده، به سمت تولید بیشتر آن (سمت فراورده) میرود؛ راه مناسب برای کاهش غلظت آمونیاک و خارج کردن آن از واکنش، استفاده از نقطه جوش بالاتر آن نسبت به گازهای نیتروژن و هیدروژن است، که میتوانیم با کاهش دما آمونیاک را تبدیل به مایع کنیم، و از واکنش خارج کنیم. بدین صورت، واکنش برای جبران کاهش غلظت آمونیاک، بیشتر به سمت فراورده پیشرفت میکند و آمونیاک بیشتری تولید میشود.
با انجام این تغییرات که به روش هابر معروف است، میزان درصد مولی آمونیاک در این مخلوط گازهای هیدروژن، نیتروژن و آمونیاک؛ به 28 درصد میرسد. (مطابق شکل ابتدای پست)
یک نظر
هر چه دما در واکنش بیشتر شود واکنش برای مصرف آن در جهت رفت حرکت میکند