همان طور که در پست سلولهای الکتروشیمی آموختیم، سلولهای الکترولیتی دارای باتری بوده و فقط یک محلول الکترولیت دارند (برخلاف سلولهای گالوانی که دو محلول الکترولیت متفاوت داشتند) و در سلول الکترولیتی، دیگر خبری از پل نمکی یا دیوار متخلخل نیست، مطابق شکل زیر که در آن تولید آلومینیوم به روش دانشمندی به نام چارلز مارتین هال را مشاهده میکنیم:
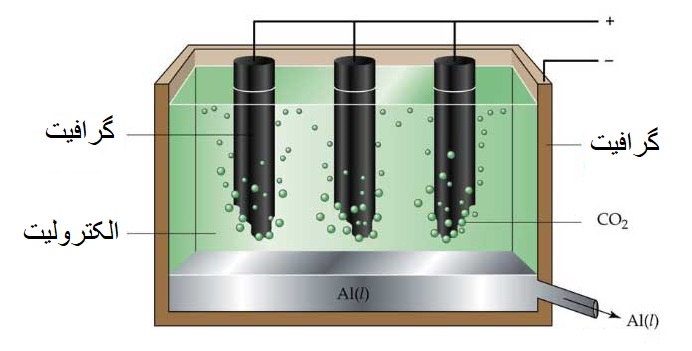
فرایند کلی تهیه آلومینیوم مذاب از آلومینیوم اکسید به صورت زیر میباشد:
2Al2O3(s)+3C(s)→4Al(l)+3CO2(g)
علیرغم آنکه این روش در زمان خود انقلابی برای تولید آلومینیوم به پا کرد ولی امروزه برای تهیه فلز آلومینیوم از بازیافت آن استفاده میکنیم، چون برای مذاب کردن آلومینیوم اکسید حتی در حضور ترکیبهای مناسب در الکترولیت آن، نیاز به انرژی بسیار بالایی داریم، به صورتی که تولید قوطیهای آلومینیوم از قوطیهای کهنه (روش بازیافت)، فقط به 7% انرژی لازم برای تهیه همان تعداد قوطی به روش هال نیاز داریم.