لایههای عناصر در یک گروه از بالا به پایین زیاد میشود، مثلا در گروه اول ابتدا هیدروژن قرار دارد که در دوره اول حضور داشته، پس الکترون آن در لایه اول میباشد، پایینتر از هیدروژن، لیتیم واقع شده که در دوره دوم قرار دارد، پس در لایه دوم الکترون دارد، بعد از آن، سدیم است که در دوره یا لایه سوم الکترون داشته و بدین ترتیب این روند تا انتهای گروه اول ادامه دارد.
در نتیجه در هر گروهی از بالا به پایین با افزایش دوره، لایههای دارای الکترون نیز افزایش یافته و شعاع اتمی بزرگتر میشود.
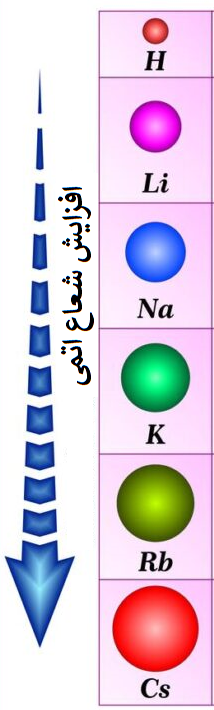
ولی باید دقت داشت که در یک گروه از بالا به پایین، بار موثر هسته نیز افزایش مییابد.
بار موثر هسته همان نیرویی است که از طرف هسته یک اتم به الکترونهای دور و نزدیک اطرافِ هسته وارد میشود، و طبعا هرچه تعداد پروتونهای درون هسته اتم بیشتر باشد، نیروی وارد شده از هسته به الکترونهای اطراف نیز بیشتر است و آنها را (یعنی الکترونها را) بیشتر سمت خود میکشد، از طرفی میدانیم که تعداد پروتونهای یک اتم همان عدد اتمی است، پس میتوان نتیجه گرفت که هر چه عدد اتمی بیشتر باشد بار موثر هسته نیز بیشتر است.
اما سوالی که مطرح میشود این است که در یک گروه از بالا به پایین با وجود افزایش عدد اتمی یا بار موثر هسته، چرا شعاع اتمی عناصر بیشتر میشود؟
پاسخ آسان است، چون روند افزایش لایهها از روند افزایش بار موثر هسته بیشتر است، پسبا وجود افزایش بار موثر هسته در یک گروه، شعاع اتمی نیز افزایش مییابد.

یک نظر
رادیم زیرا از بالا به پایین در یک گروه شعاع اتمی افزایش یافته و لایه ها بیشتر شده و تعداد الکترون ها نیز بیشتر شده