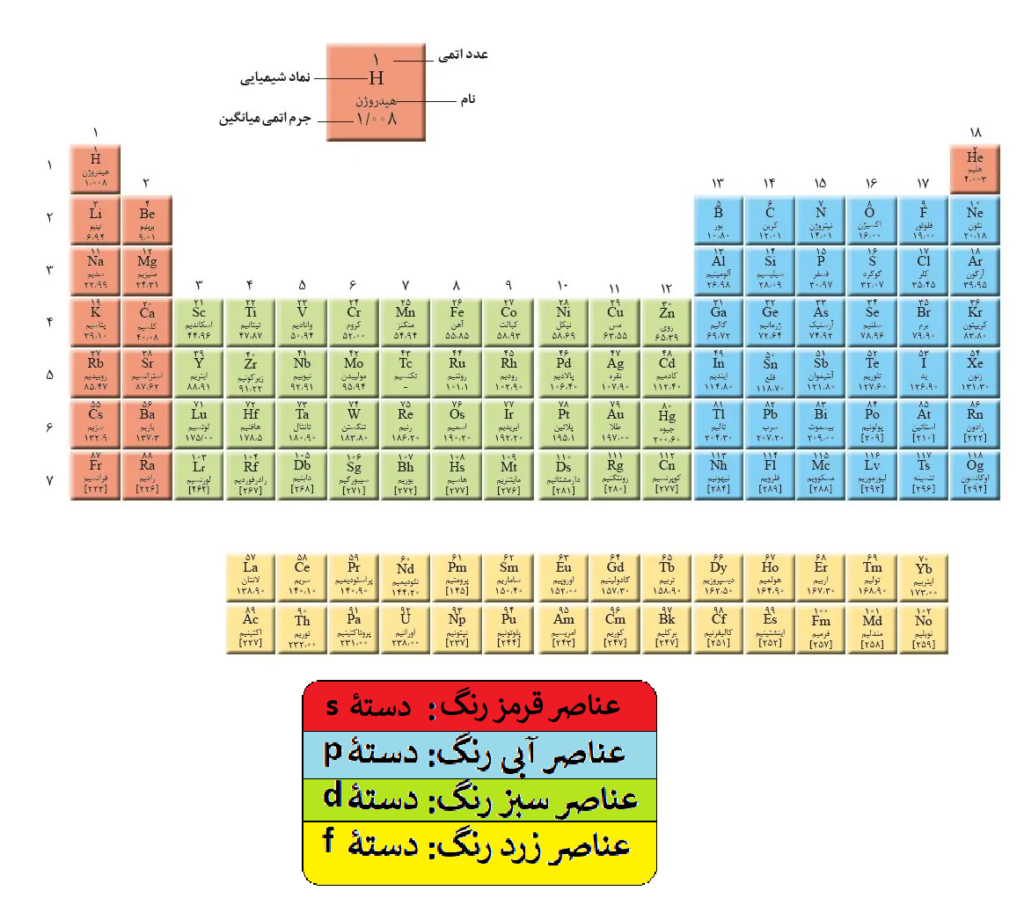
بیشترین لایه (n) در آرایش الکترونی فشرده نشان دهندۀ دوره عنصر در جدول تناوبی است.
تعداد الکترونهای ظرفیتی هم نشان دهنده شماره گروه عنصر است با اشاره به این مورد که عناصر دسته p چون در آخر جدول قرار گرفتهاند، برای تعیین گروهشان، الکترونهای ظرفیتی آنها را به اضافه 10 میکنیم.
مثلا میخواهیم مشخص کنیم تعداد الکترونهای ظرفیتی کلسیم (20Ca) و کروم (24Cr) و فسفر (15P) و ژرمانیم (32Ge) چند است:
اول با کلسیم (20Ca) شروع میکنیم:
20Ca:[Ar]4s2
همان طور که میبینیم کلسیم جزو عناصر دسته s هست، و تعداد الکترونهای ظرفیتی کلسیم 2 تا هست، پس کلسیم در گروه 2 قرار دارد؛ و چون بیشترین لایه آن 4 است (4s2) پس در دوره 4 قرار دارد.
حالا بریم سراغ کروم (24Cr) :
24Cr:[Ar]4s1 3d5
همان طور که مشاهده میکنیم کروم جزو عناصر دسته d هست، و بعد از گاز نجیب در آرایش الکترونی آن 6 الکترون وجود دارد (4s1 3d5)، پس تعداد الکترونهای ظرفیتی کلسیم 6 تا هست، در نتیجه در گروه 6 قرار دارد، و چون بیشترین لایه آن 4 است (4s1) پس در دوره 4 قرار دارد.
بریم سراغ فسفر (15P):
15P:[Ne]3s2 3p3
همان طور که میبینیم فسفر جزو عناصر دسته p هست، و بعد از گاز نجیب در آرایش الکترونی آن 5 الکترون وجود دارد (3s2 3p3)، پس تعداد الکترونهای ظرفیتی فسفر 5 تا هست، ولی با توجه به اینکه جزو عناصر دسته p هست، باید تعداد الکترونهای ظرفیتی آن به اضافه 10 شود، پس گروه فسفر میشود: 15 (15=10+5) و دوره آن 3 است، زیرا بیشترین لایه آن 3 است.
و در آخر ژرمانیم (32Ge):
32Ge:[Ar]4s2 3d10 4p2
همان طور که میبینیم ژرمانیم جزو عناصر دسته p هست، ، و تعداد الکترونهای ظرفیتی ژرمانیم 4 تا هست (4s24p2) (از الکترونهای زیرلایه d برای الکترونهای ظرفیتی دسته p صرف نظر میکنیم) از طرفی چون این عنصر جزو دسته p است، تعداد الکترونهای ظرفیتی آن باید به اضافه 10 شود، پس گروه ژرمانیم میشود: 14 (14=10+4) و دوره آن 4 است، زیرا بیشترین لایه این عنصر 4 است.