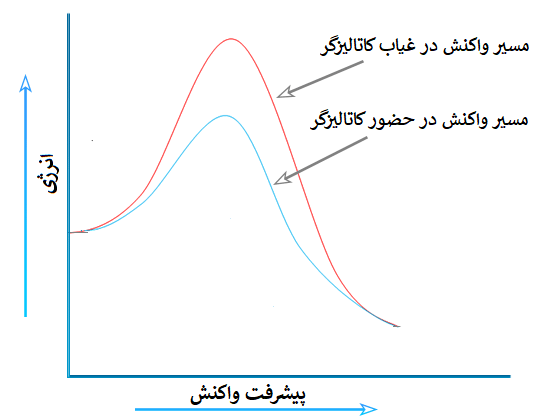
در پست انرژی فعال سازی متوجه شدیم که هر چه انرژی فعال سازی (Ea) یک واکنش بیشتر باشد مسیر انجام واکنش طولانیتر بوده و واکنش دهندهها دیرتر و کندتر به فراوردهها تبدیل میشوند.
در نتیجه با حضور کاتالیزگر، مسیر انجام واکنش کوتاه شده و انرژی فعال سازی کاهش مییابد، که منجر به سریعتر انجام شدن واکنش میگردد، طبق نمودار زیر:
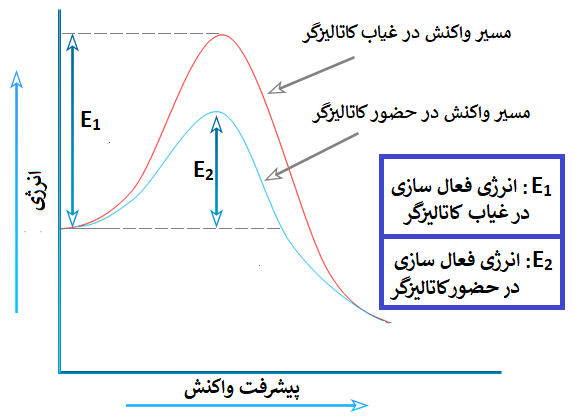
همچنین در پست کاتالیزگر شیمی 2 دریافتیم که کاتالیزگر:
موردی که دربارۀ کاتالیزگر جالب است، این هست که خودش در واکنش مصرف نمیشود؛ مثلا با نگاه کردن به دو واکنش پایین، میتونیم متوجه شویم ماده B کاتالیزگر است، زیرا به همان میزان که ماده B در واکنش اول مصرف میشود، در واکنش دوم تولید میشود؛ پس در مجموع تغییری نمیکند و تمام نمیشود:
فراموش نکنیم که: کاتالیزگر توانایی تغییر آنتالپی واکنش (H∆) را ندارد و فقط سرعت واکنش را تغییر میدهد، به عبارتی H∆ در حضور کاتالیزگر با H∆ در غیاب کاتالیزگر برابر هستند، مطابق نمودار زیر:
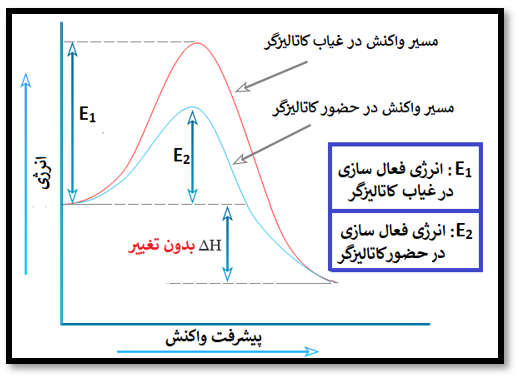
چون طبق نمودار بالا، آنتالپی واکنش، فقط به مقدار انرژی اولیه (انرژی واکنش دهنده) و پایانی (انرژی فراورده) بستگی دارد ولی کاتالیزگر فقط مسیر انجام واکنش و انرژی فعال سازی را کاهش میدهد؛ در صورتی که آنتالپی هیچ ارتباطی به مسیر انجام واکنش ندارد.
گاهی به جای کاتالیزگر از واژههای کاتالیزور یا کاتالیست هم استفاده میشود.
یک نظر
۲،زیرا انرژی فعال سازی در حضور کاتالیزور کمتر شده